题目内容
下列方程式不正确的是
| A.用稀H2SO4吸收氨气:NH3+H+=NH4+ |
| B.少量的CO2通入NaOH溶液中:CO2+2OH-=CO32-+H2O |
| C.铜溶解于氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| D.足量铁溶于稀硝酸,溶液变成浅绿色:Fe+4H++NO3-=Fe3++NO↑+2H2O |
D
试题分析:A.原理无误,拆写符合离子方程式的书写标准。正确。B.拆写符合离子方程式的标准。正确。C.原理正确拆写无误。D.Fe是变价金属,由于Fe足量。所以与硝酸反应时产生的为Fe2+.反应的化学方程式为3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.原理错误。

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
 Mn2+ + 2H2O + Cl2↑
Mn2+ + 2H2O + Cl2↑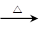 HCOO-+NH4++2Ag↓+3NH3+H2O
HCOO-+NH4++2Ag↓+3NH3+H2O
 Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-
Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-