题目内容
现有浓度分别为1 mol/L的FeCl3、FeCl2、CuCl2混合溶液100 mL,加入一定量的铁粉,按下列情况填空。
(1)充分反应后,如果溶液中还有一定量的Cu2+,则溶液中一定含有的金属离子还有___________,该离子在溶液中的物质的量范围为________________,可能含有的金属或金属离子为____________。
(2)反应完毕后,铁粉有剩余,溶液中一定含有的金属离子为___________,为______mol,
一定没有的金属离子为______________。
(3)若向FeCl3溶液中加入适量氢碘酸,发生反应的离子方程式为____________________。
(4)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O。该反应的化学方程式为________________________________;若反应过程中转移了0.3mol电子,则氧化产物的质量是___________g;生成的气体在标况下的体积是________L。
(1)充分反应后,如果溶液中还有一定量的Cu2+,则溶液中一定含有的金属离子还有___________,该离子在溶液中的物质的量范围为________________,可能含有的金属或金属离子为____________。
(2)反应完毕后,铁粉有剩余,溶液中一定含有的金属离子为___________,为______mol,
一定没有的金属离子为______________。
(3)若向FeCl3溶液中加入适量氢碘酸,发生反应的离子方程式为____________________。
(4)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O。该反应的化学方程式为________________________________;若反应过程中转移了0.3mol电子,则氧化产物的质量是___________g;生成的气体在标况下的体积是________L。
(1)Fe2+ 0.1 mol<n(Fe2+)<0.35 mol Cu或Fe3+
(2)Fe2+ 0.35 Fe3+、Cu2+
(3)2Fe3+ +2I- =2Fe2+ + I2
(4)3H2S+2HNO3=3S+2NO↑+4H2O 4.8 2.24L
(2)Fe2+ 0.35 Fe3+、Cu2+
(3)2Fe3+ +2I- =2Fe2+ + I2
(4)3H2S+2HNO3=3S+2NO↑+4H2O 4.8 2.24L
试题分析:(1)微粒的氧化性Fe3+> Cu2+> Fe2+.所以加入一定量的Fe粉时首先发生反应:2Fe3++Fe=3Fe2+.当Fe3+反应完全后,再发生反应:Cu2++Fe= Fe2+ +Cu2+.由方程式可看出一定含有Fe2+离子。若Fe3+、Cu2+未发生反应,则n(Fe2+)=0.1mol.若Fe3+、Cu2+反应完全,则n(Fe2+)=3/2n(Fe3+)+ n(Fe2+)+n(Cu2+)="0.15mol" +0.1mol+0.1mol="0.35mol." 由于溶液中还含有一定量的Cu2+,即第二个反应没有完全,所以Fe2+的物质的量应该比0.35mol要少。故Fe2+的物质的量的范围是0.1 mol<n(Fe2+)<0.35 mol。可能含有的金属或金属离子为Cu或Fe3+。(2)由于反应完毕后,铁粉有剩余,说明上述两个反应进行的完全。故溶液中一定含有的金属离子为Fe2+,其物质的量为0.35mol,一定不会含有Fe3+、Cu2+。(3)由于Fe3+有氧化性,I-有还原性,所以向FeCl3溶液中加入适量氢碘酸,发生反应的离子方程式为2Fe3++2I-=2Fe2++I2.(4)根据氧化还原反应的规律:强氧化性的物质与强还原性的物质反应产生弱氧化性的物质和弱还原性的物质。可得方程式3H2S+ 2HNO3 =3S+2NO↑+4H2O。在反应方程式中转移电子6mol,时,得到氧化产物S单质3mol,也就是96g,得到的还原产物NO物质的量为2mol.现在转移电子0.3mol,所以得到的氧化产物质量为(0.3mol×96g)÷6mol=4.8g. 得到的还原产物NO的体积为(2mol×22.4L/mol×0.3mol)÷6mol=2.24L.

练习册系列答案
相关题目
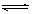 2H++Cl-+ClO-
2H++Cl-+ClO-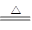 NH3↑+Al(OH)3↓+2BaSO4↓+H2O
NH3↑+Al(OH)3↓+2BaSO4↓+H2O H2↑+Cl2↑
H2↑+Cl2↑