题目内容
13.下列说法正确的是( )| A. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| B. | CO2通入水玻璃中可得硅酸 | |
| C. | 因高温时,SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 | |
| D. | 石英是制造玻璃的主要原料之一,它在常温下不与NaOH溶液反应 |
分析 A.二氧化硅与氢氟酸常温下能够反应;
B.碳酸酸性强于硅酸;
C.要证明H2CO3酸性比H2SiO3强,应该采用常温下强酸制取弱酸的方法;
D.石英主要成分是二氧化硅,二氧化硅为酸性氧化物,常温下能够与氢氧化钠溶液反应.
解答 解:A.二氧化硅与氢氟酸常温下能够反应生成四氟化硅和水,能够溶解在氢氟酸中,故A错误;
B.CO2通入水玻璃中发生反应生成硅酸和碳酸钠,故B正确;
C.要证明H2CO3酸性比H2SiO3强,应该采用常温下强酸制取弱酸的方法,应该将二氧化碳通入硅酸钠溶液中观察是否产生白色沉淀,如果产生白色沉淀就说明H2CO3酸性比H2SiO3强,故C错误;
D.石英主要成分是二氧化硅,二氧化硅为酸性氧化物,常温下能够与氢氧化钠溶液反应,故D错误;
故选:B.
点评 本题考查了元素化合物知识,侧重考查二氧化硅的性质,明确二氧化硅为酸性氧化物,熟悉其常温下能够与氢氟酸、氢氧化钠反应是解题关键,题目难度不大.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| B. | 酸性氧化物都只能与碱反应不能与任何酸发生反应 | |
| C. | 工业上用焦炭和石英制取粗硅的反应方程式为SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| D. | 不能用SiO2与水反应的方法来制取硅酸,不能用瓷坩埚来加热烧碱或纯碱使其熔化 |
18.下列关于元素周期律和元素周期表的说法中错误的是( )
| A. | 元素周期律的实质是元素原子的核外电子排布呈周期性变化 | |
| B. | 利用元素周期律可以预测元素及其化合物的性质 | |
| C. | 元素周期表有7个横行,也就是7个周期 | |
| D. | 元素周期表有18个纵列,也就是18个族 |
5.向一密闭容器中充入SO2和18O2,反应一段时间后,18O可能存在于( )
| A. | SO3、O2 | B. | 只有O2 | C. | SO2、SO3和O2 | D. | SO2和SO3 |
2.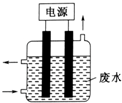 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )| A. | 可以用石墨作阳极,作铁阴极 | |
| B. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| C. | 阴极的电极反应式为:Cl-+2OH-+2e-═ClO-+H2O | |
| D. | 阳极的电极反应式为:2CN-+12OH--10e-═N2↑+2CO32-+6H2O |
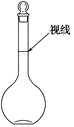 实验室配制500mL 0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的Na2SO4溶液,实验操作步骤有: