题目内容
15.(1)用20.8g氯化钡配制成500mL溶液,其物质的量浓度为0.2mol/L;(2)若从中取出50mL,其物质的量浓度为0.2mol/L,溶质的质量为2.08g;
(3)若将这50mL溶液用水稀释到100mL,所得溶液中Ba2+的物质的量浓度为0.1mol/L,Cl-的物质的量浓度为0.2mol/L.
分析 (1)根据n=$\frac{m}{M}$、c=$\frac{n}{V}$计算出该溶液中氯化钡的物质的量浓度;
(2)溶液具有均一性,则取出的溶液浓度不变;根据m=nM=cVM计算出含有溶质的质量;
(3)根据稀释过程中溶质的物质的量不变计算出所得溶液中钡离子、氯离子的浓度.
解答 解:(1)20.8g氯化钡的物质的量为:n(BaCl2)=$\frac{20.8g}{208g/mol}$=0.1mol,
该溶液中氯化钡的物质的量浓度为:c(BaCl2)=$\frac{0.1mol}{0.5L}$=0.2mol/L,
故答案为:0.2;
(2)若从中取出50mL,溶液的浓度不变,则其物质的量浓度为0.2mol/L;
该50mL溶液中含有氯化钡的质量为:m(BaCl2)=208g/mol×0.2mol/L×0.05L=2.08g,
故答案为:0.2;2.08;
(3)若将这50mL溶液用水稀释到100mL,稀释过程中溶质的物质的量不变,则所得溶液中Ba2+的物质的量浓度为:c(Ba2+)=$\frac{0.2mol×0.05L}{0.1L}$=0.1mol/L,Cl-的物质的量浓度为钡离子浓度的2倍,即:c(Cl-)=2c(Ba2+)=0.2mol/L,
故答案为:0.1;0.2.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度等物理量之间的关系,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
相关题目
5.某溶液中只可能含有下列离子的几种:Na+、NH4+、Ba2+、SO42-、I-、CO32-为了确定该溶液中的离子种类,某学生已做了以下两个实验:①取样,用pH计测试,溶液显弱酸性;②另取样,加氯水和淀粉无明显现象.还需检验的离子是( )
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
6.发射卫星的火箭通常用肼(N2H4)作燃料,用NO2作氧化剂,燃烧过程中无污染物生成,现已知
N2 (g)+2O2(g)=2NO2(g);△H=-67.2KJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534KJ/mol
则1moL肼在足量的NO2中燃烧时放出的热量为( )
N2 (g)+2O2(g)=2NO2(g);△H=-67.2KJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534KJ/mol
则1moL肼在足量的NO2中燃烧时放出的热量为( )
| A. | 601.17KJ | B. | 67.2KJ | C. | 534KJ | D. | 500.4KJ |
3.下列溶液中,溶质的物质的量浓度最大的是( )
| A. | 40mL 5mol/L的盐酸 | B. | 500mL 1mol/L的氯化钠溶液 | ||
| C. | 100mL 3mol/L的硫酸 | D. | 250mL 2mol/L的氢氧化钠溶液 |
10.下列说法中正确的是( )
| A. | NaHSO4显强酸性,因此从组成上分类它应该属于酸 | |
| B. | 含Fe元素质量分数为70%的Fe2O3是纯净物 | |
| C. | CuSO4•5H2O是混合物 | |
| D. | 显碱性的物质一定为碱 |
6.下列有机物命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. | 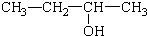 3-丁醇 3-丁醇 | ||
| C. | 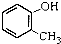 间甲基苯酚 间甲基苯酚 | D. | 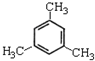 1,3,5-三甲基苯 1,3,5-三甲基苯 |
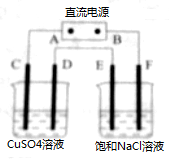 如图所示,A是直流电源的正极,C、D均为石墨电极,E、F均为铜电极.分别写出C、D、E、F四个电极的电极反应式.
如图所示,A是直流电源的正极,C、D均为石墨电极,E、F均为铜电极.分别写出C、D、E、F四个电极的电极反应式.