题目内容
某溶液中大量存在以下浓度的五种离子:0.2 mol·L-1 Cl-、0.4 mol·L-1 SO42-、0.1 mol·L-1 Al3+、0.3 mol·L-1 H+、M,则M及其物质的量浓度可能为( )。
| A.Na+ 0.3 mol·L-1 | B.Zn2+ 0.2 mol·L-1 |
| C.CO32- 0.2 mol·L-1 | D.Ca2+ 0.1 mol·L-1 |
B
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.0.2 NA个氢分子的体积为4.48 L |
| B.常温常压下,5.85gNaCl中含有0.1NA个分子 |
| C.200mL 1 mol·L-1的Fe2(SO4)3溶液中Fe3+数小于0.4NA |
| D.1 molCl2与足量NaOH溶液充分反应,转移的电子数为2NA |
20mL 1mol ·L_1NaOH与1mol ·L_1的硫酸反应,溶液呈中性,则硫酸的体积为 ( )
| A.5 mL | B.l0 mL |
| C.20 mL | D.40 mL |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.22.4 L O2中含有氧分子的个数为NA |
| B.24g Mg与足量氧气反应转移的电子数为2NA |
| C.28g N2中含有氮原子的个数为NA |
| D.1 mol·L-1MgCl2溶液中含有氯离子个数为2NA |
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用图所示装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。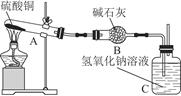
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4
 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑ B. 3CuSO4
 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑C.5CuSO4
 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑ D.6CuSO4
 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑ 两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42—,若将2.83 g X中的Cr3+全部氧化为Cr2O72—后,溶液中的Cr2O72—可和过量KI溶液反应,得到3.84 g I2。反应的离子方程式为Cr2O72—+6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀,由此可推断出X的化学式为( )
| A.K2SO4·Cr2(SO4)3 | B.2K2SO4·Cr2(SO4)3 |
| C.K2SO4·2Cr2(SO4)3 | D.K2SO4·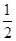 Cr2(SO4)3 Cr2(SO4)3 |
某混合气体X,可能由H2、CO、CO2和水蒸气中的一种或几种组成,现将混合气体通入灼热的CuO,完全反应后,固体 CuO质量减少1.6 g;再将反应后的混合气体全部导入足量的澄清石灰水中,生成白色沉淀10 g。根据以上信息,分析下列有关X的组成推断正确的是( )
| A.X一定只由CO组成 |
| B.X一定只由H2和CO2组成 |
| C.X可能由0.1 g H2和4.4 g CO2组成 |
| D.X可能由0.1 g H2、1.4 g CO、2.2 g CO2组成 |
下列有关化学用语表示正确的是( )。
A.CO2的电子式: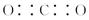 |
B.质子数为43、中子数为56的Tc原子: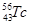 |
C.Cl-的结构示意图: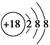 |
D.氨基乙酸的结构简式: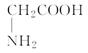 |
阿伏加德罗常数的值可以用NA表示,下列说法中正确的是 ( )。
| A.P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则1 mol该分子中含有的共价键数目是12NA |
| B.28 g氮气和4 g氦气所含的原子数目相等,均为NA个 |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA,小于0.2NA |
| D.Fe和水蒸气在加热条件下反应,生成1 mol H2,则转移电子的数目为NA |