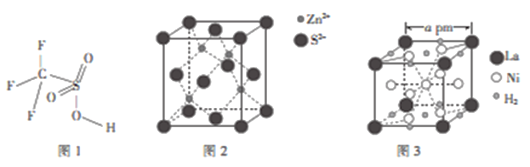
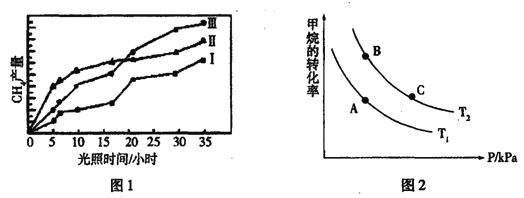
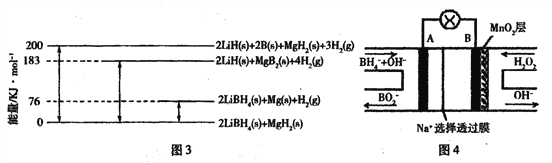
题目内容
【题目】硫酸钠和氯化钠溶液等体积混合后,钠离子浓度为0.7mol·L-1, 硫酸根离子的浓度为0.2mol·L-1,则混合液中氯离子的浓度为:
A.0.15mol·L-1B.0.3mol·L-1C.0.45mol·L-1D.0.2mol·L-1
【答案】B
【解析】
在混合溶液中,正负电荷的数量是相等的,所以设氯离子浓度为x mol/L,则由电荷守恒得:0.7×1=0.2×2+x×1,解得 x=0.3mol/L,答案选B。

练习册系列答案
相关题目
【题目】煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K随温度的变化如下表:
H2(g)+CO2(g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2(g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C(s)+H2O(g)![]() H2(g)+CO(g)平衡常数K2,
H2(g)+CO(g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).