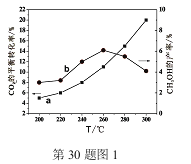
题目内容
【题目】下列说法中正确的是( )
A. s电子云是在空间各个方向上伸展程度相同的对称形状
B. p电子云的形状是对顶双球
C. L电子层有d轨道
D. 2p轨道有一个未成对电子的基态原子和价电子排布为2s22p5的原子是同种元素的原子
【答案】A
【解析】A、s电子云是球形对称的,因此s电子云是在空间各个方向上伸展程度相同的对称形状,A正确;B、p电子云是哑铃形,B错误;C、L电子层只有2s、2p两个能级,故无d轨道,C错误;D、2p轨道上有一个未成对电子的基态原子为B或F,D错误,答案选A。

【题目】甲乙两同学分别对含+4价硫元素的物质性质进行了探究。
(1)甲用下图装置进行实验(气密性已检验,加热和夹持装置已略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4。
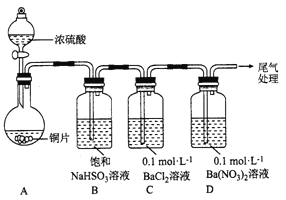
① A中反应的化学方程式是______________。
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现由色沉淀的过程中,D溶液中NO3-浓度几乎不变。甲据此得出结论:D中出现白色沉淀的主要原因是__________________。
(2)乙用如下实验对含+4价疏元素的物质性质继续进行探究。
序兮 | 实验搡作 | 实聆现象 |
1 | 取0.3g纯净Na2SO3固体,向其中加人10mL 2 mol/L盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡,滴入BaCl2溶液后,开始无现象,4 min后,溶液变浑浊 |
2 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2 mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2 h后,溶液变浑浊 |
3 | 取0.3g纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
①用离子方程式解释实验1中产生现象的原因:________________。
② 由实验1、2、3对比,可以得到推论:________________。
③乙通过査阅资料发现.Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和 NO3-对其的影响:
序号 | 实验操作 | 实验现象 |
4 | 取____固体混合物,向其中加入10mL2 mol /LHNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;:滴入BaCl2溶液后,开始无现象,20 min后,溶液变浑浊 |
i.实验2和4对比,乙获得推论:C1-的存在可以加快溶液中+4价硫元索的氧化;
ii.实验I和4对比,乙获得推论: ______________。
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加____________ (填字母序号)。
a.2 mol/L盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
B.2 mol/L盐酸,再滴加BaCl2溶液,立即出现白色沉淀
C.2 mol/L硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
D.2 mol/L硝酸,再滴加BaCl2溶液,立即出现白色沉淀
【题目】KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO (OH)2,因此配制KMnO4标准溶液的操作是: (1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h; (2)用微孔玻璃漏斗过滤除去难溶的MnO (OH)2; (3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处; (4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂 (纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是 。
(2)如何保证在700C~800C条件下进行滴定操作: 。
(3)准确量取一定体积的KMnO4溶液用 (填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用 (填序号)。
A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(5)若准确称取Wg你选的基准试剂溶于水配成500mL水溶液,取25.00mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是 ;
②所配制KMnO4标准溶液的物质的量浓度为 ;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将 (填“偏高”或“偏低”)。