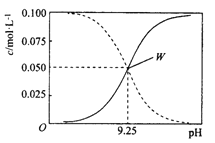
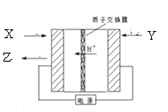
题目内容
【题目】关于等质量的SO2和SO3的比较,正确的是
A.所含氧原子的个数比为2:3 B.所含硫原子的个数比为1:1
C.所含硫元素的质量比为5:4 D.所含原子个数比为3:4
【答案】C
【解析】
试题分析:等质量m的SO2和SO3的物质的量分别为m/64,m/80,物质的量之比5:4。A.所含氧原子的个数比为5×2:4×3=5:6,A项错误;B. 所含硫原子的个数比为5:4,B项错误;C. 所含硫元素的质量比为5:4,C项正确;D.所含原子个数比为5×3:4×4=15:16,D项错误;答案选C。

【题目】【化学——选修3:物质结构与性质】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
元索 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有一个未成对电子 |
X | X原子的第一离能至第四电离能分别I1="578" kJ/mol; I2=" l817" kJ/mol;I3="2745" kJ/mol;I4=11575kJ/mol |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1) TY2是一种常用的溶剂,是__________(填“极性分子”或“非极性分子”),分子中存在________个σ键。
(2)W的最简单氢化物容易液化,理由是__________,.放热419 kJ,该反应的热化学方程式为 __________。
(3)基态Y原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为_____________、电子数为_________。Y、氧、W元素的第一电离能由大到小的顺序为_________(用元素符号作答)。
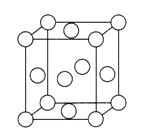
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为___________cm;ZYO4常作电镀液,其中ZYO42-的空间构型是__________,其中Y原子的杂化轨道类型是___________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移