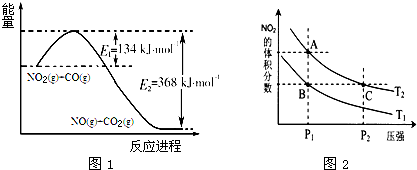
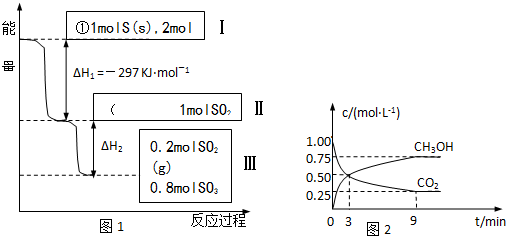
题目内容
下列说法或表示方法正确的是( )
| A.反应物的总能量低于生成物的总能量时,该反应一定不能发生 |
| B.由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0 |
C.已知:2SO2(g)+O2(g)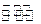 2SO3(g)△H=一98.3kJ/mol。将lmolSO2和0.5molO2 2SO3(g)△H=一98.3kJ/mol。将lmolSO2和0.5molO2充入 一密闭容器中充分反应,放出49.15kJ的热量[来源:学。科。网] |
| D.在101kPa、25℃时,lgH2完全燃烧生成气态水,放出120.9kJ的 |
B
解析

练习册系列答案
相关题目
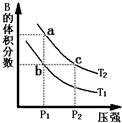 对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.
对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.