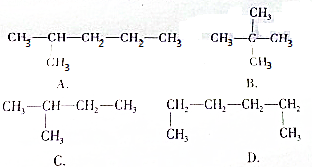题目内容
20.甲醇、乙二醇、丙三醇分别同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,则消耗这三种醇的物质的量之比为( )| A. | 3:2:1 | B. | 1:2:3 | C. | 2:3:6 | D. | 6:3:2 |
分析 醇中羟基与钠反应生成氢气,反应生成的氢气相同,根据H原子守恒,生成氢气的物质的量之比等于醇中羟基物质的量之比,据此计算醇的物质的量之比.
解答 解:乙醇、乙二醇、丙三醇分别有1、2、3个羟基,羟基与Na反应生成氢气,即羟基中H原子转化生成氢气,反应生成的氢气相同,根据H原子守恒,生成氢气的物质的量之比为1:1:1,则醇中羟基物质的量之比为1:1:1,设羟基为nmol,则乙醇为nmol,乙二醇为$\frac{n}{2}$mol,丙三醇为$\frac{n}{3}$mol,
则消耗这三种醇的物质的量之比为n:$\frac{n}{2}$:$\frac{n}{3}$=6:3:2,
故选D.
点评 本题考查化学方程式有关计算,理解醇与Na反应本质是关键,利用守恒法计算,避免利用方程式计算的繁琐.

练习册系列答案
相关题目
13.能通过化学反应使溴水褪色,又能使高锰酸钾酸性溶液褪色的是( )
| A. | 乙烷 | B. | 乙醇 | C. | 乙酸 | D. | 二氧化硫 |
15.下列离子方程式中,书写正确的是( )
| A. | 碳酸钠与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | Fe与稀盐酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 铜与浓硝酸反应:Cu+H++NO3-═Cu2++NO2↑+H2O |
5.下列说法中正确的是( )
| A. | Cu和Fe相连插入某溶液中形成原电池,则Fe一定作负极 | |
| B. | MgCl2中混有少量的FeCl3,可以通过溶解,加入过量MgO、过滤、结晶等操作进行提纯 | |
| C. | 用惰性电极电解CuSO4溶液一段时间后,若需加入适量的Cu(OH)2才能使溶液恢复到电解前状态,说明阴极只有Cu2+被还原 | |
| D. | 将Fe、Cu的混合物投入FeCl2和CuCl2的混合溶液中,最后可能只有Fe剩余 |
12.m g下列有机物完全燃烧后,产生的气体通过足量的Na2O2固体,固体增重m g的是( )
| A. | 乙醇 | B. | 乙酸 | C. | 甲醇 | D. | 乙醛 |
 .
.