题目内容
【题目】已知:相关反应的热化学方程式如下:
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) ΔH1=-175.6 kJ·mol1(反应Ⅰ)
CaS(s)+4CO2(g) ΔH1=-175.6 kJ·mol1(反应Ⅰ)
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH2=+218.4 kJ·mol1(反应Ⅱ)
CaO(s)+SO2(g)+CO2(g) ΔH2=+218.4 kJ·mol1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是
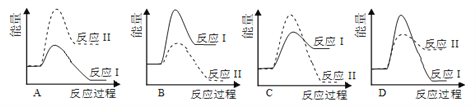
A. A B. B C. C D. D
【答案】D
【解析】反应Ⅰ为放热反应,反应Ⅱ为吸热反应,则选项B、C中表现的反应热曲线错误,因为两图中生成物总能量高于反应物总能量,由题意知:反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较小,则选项A错误、选项D正确,答案选D。

练习册系列答案
相关题目