题目内容
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填空.
(1)如图是常见仪器的部分结构。
A.  B.
B. ![]() C.
C.  D.
D. 
①写出仪器名称:B_____,C______。
②使用前需检查是否漏水的仪器有______________。(填仪器标号)
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____,滴定终点时,锥形瓶中颜色变化为_______,且半分钟内颜色不复原。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______。
A .酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B .滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C .酸式滴定管在滴定前有气泡,滴定后气泡消失
D .读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
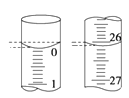
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL。
(5)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度______。(保留两位有效数字)
【答案】容量瓶 滴定管 BC 锥形瓶溶液颜色的变化 淡红色突变为无色 D 26.10 0.10mol/L
【解析】
(1)①根据仪器结构特点判断;
②凡是带有活塞,旋塞的仪器使用前一般需要检查是否漏水;
(2)滴定过程中眼睛应注视锥形瓶溶液颜色的变化;酚酞在pH<8.2的溶液里为无色,滴定终点溶液显中性,据此判断滴定终点颜色变化;
(3)依据c(待测)=![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差;
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)根据滴定管的结构和精确度以及测量的原理;
(5)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出c(NaOH).
(1)①仪器B带有瓶塞,且瓶颈细,有刻度线无刻度为容量瓶;C带有刻度,小数在上,大数在下,为滴定管;
②容量瓶带有活塞,滴定管带有旋塞,为防止漏液,使用前应检查是否漏水;故选:BC;
(2)滴定过程中眼睛应注视锥形瓶溶液颜色的变化;用标准的盐酸滴定待测的NaOH溶液时,用酚酞做指示剂,开始溶液显碱性,所以锥形瓶中溶液颜色为红色,随着盐酸的加入量增多,溶液碱性减弱,颜色逐渐变浅,当由淡红色突变为无色,且半分钟内颜色不复原,即达到终点;
(3)A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,导致标准液被稀释,所需标准液体积偏大,溶液浓度偏高,故A不选;
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,对消耗标准液的体积不产生影响,溶液浓度无影响,故B不选;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,溶液浓度偏高,故C不选;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,溶液浓度偏低,故D选;
故选:D;
(4)滴定管小刻度在上,大刻度在下,精确值为0.01mL,起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL;
(5)根据数据的有效性,第2组数据偏差较大,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=25.00mL,则:c(待测)=![]()
![]() =0.10mol/L。
=0.10mol/L。

【题目】某实验小组探究常温下难溶电解质的溶解平衡,查得如下资料:
难溶电解质 | FeS | CuS | Mg(OH)2 | Fe(OH)3 |
Ksp(溶解平衡常数) | 6.3×10-18 | 6.3×10-36 | 1.8×10-11 | 4.0×10-38 |
依据上述数据进行的预测不合理的是
A.向饱和FeS溶液中加入少量Na2S固体,有浑浊出现
B.除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂
C.向含等物质的量的MgCl2和FeCl3的混合溶液中逐滴加入NaOH溶液,最先出现的沉淀是Mg(OH)2
D.向1mL 0.1 mol·L—1MgCl2溶液中滴加2mL0.1mol·L—1 NaOH溶液,取澄清溶液滴加2滴0.1mol·L—1 FeCl3溶液,有浑浊出现