题目内容
15.实验室需要1mol•L-1硫酸溶液500mL,根据计算得知,所需质量分数为98%、密度为1.84g•cm-3的浓硫酸的体积为27.2mL(计算结果保留一位小数).分析 根据c=$\frac{1000ρω}{M}$计算出该浓硫酸的物质的量浓度,再根据配制过程中溶质硫酸的物质的量不变计算出需要浓硫酸的体积.
解答 解:分数为98%、密度为1.84g•cm-3的浓硫酸的浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
配制过程中硫酸的物质的量不变,则需要该浓硫酸的体积为:$\frac{1mol/L×0.5L}{18.4mol/L}$≈0.0272L=27.2mL,
故答案为:27.2.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握稀释定律在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3.液氨和水类似,也能电离:NH3+NH3?NH4++NH2-,25℃时,其离子积K=1.0×10-30 mol2•L-2.现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)( )
| A. | c(Na+)=c(NH2-) | B. | c(NH4+)=1×10-29 mol•L-1 | ||
| C. | c(NH2-)>c(NH4+) | D. | c(NH4+).c(NH2-)=1.0×10-30 mol2•L-2 |
20.下列有关说法不正确的是( )
| A. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 向紫色石蕊试液中加入新制氯水,石蕊试液先变红后褪色 | |
| D. | 区别溶液和胶体的最简单的方法是丁达尔效应 |
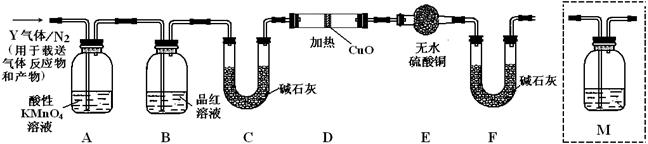 (3)装置B中试剂的作用是检验SO2是否除尽.
(3)装置B中试剂的作用是检验SO2是否除尽.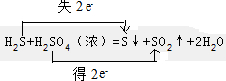 .
.