题目内容
容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g) xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是
A.x=1
B.此条件下,该反应的平衡常数K=4
C.给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D.甲和乙的平衡转化率相等
A
解析试题分析:由图象可知平衡时,甲容器平衡时,A的转化率为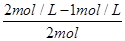 =50%,乙容器内A的转化率为
=50%,乙容器内A的转化率为 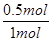 =50%,甲容器内压强比乙容器内大,增大压强平衡没动,(压强影响平衡移动的本质是改变体积进而影响反应混合物各组分的浓度),故:1+1=X,所以x=2。A项不正确。B.K=
=50%,甲容器内压强比乙容器内大,增大压强平衡没动,(压强影响平衡移动的本质是改变体积进而影响反应混合物各组分的浓度),故:1+1=X,所以x=2。A项不正确。B.K=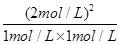 =4;C.该反应为放热反应,将乙容器单独升温,平衡向吸热反应方向移动,向逆向移动;D.由图象可知平衡时,甲容器平衡时,A的转化率为
=4;C.该反应为放热反应,将乙容器单独升温,平衡向吸热反应方向移动,向逆向移动;D.由图象可知平衡时,甲容器平衡时,A的转化率为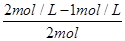 =50%,乙容器内A的转化率为
=50%,乙容器内A的转化率为 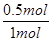 =50%,故D正确,故选D。
=50%,故D正确,故选D。
考点:考查平衡图象、等效平衡、外界条件对平衡影响、平衡计算等,难度中等,根据图象计算平衡时转化率,确定x值是解题的关键,注意B选项中压强影响平衡移动的本质是改变体积进而影响反应混合物各组分的浓度,若反应混合物难度不发生变化,平衡不移动.是易错点。

下列事实中,不能用勒夏特列原理解释的是:
| A.密闭、低温是存放氨水的必要条件 |
| B.实验室常用排饱和食盐水法收集氯气 |
| C.硝酸工业生产中,使用过量空气以提高NH3的利用率 |
| D.合成氨反应采用较高温度和使用催化剂,以提高氨气的产量 |
—定条件下,2SO2(g)+O2(g)  2SO3(g) ΔH<0。下列有关叙述正确的是
2SO3(g) ΔH<0。下列有关叙述正确的是
| A.升髙温度,v正变大,v逆变小 |
| B.恒温恒容,充入O2,O2的转化率升高 |
| C.恒温恒压,充人N2,平衡不移动 |
| D.恒温恒容,平衡前后混合气体的密度保持不变 |
一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是
| A.加入少量水,产生H速率减小,H2体积不变 |
| B.加入NH4HSO4固体,产生H2速率不变,H2体积不变 |
| C.加入CH3COONa固体,产生H2速率减小,H2体积减小 |
| D.滴加少量CuSO4溶液,产生H2速率变大,H2体积减小 |
一密闭体系中发生反应:2SO2(g)+O2(g) 2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
| A.t0→t1 | B.t2→t3 | C.t3→t4 | D.t5→t6 |
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
以下对反应过程的分析和判断正确的是
A. 反应在前50 s的平均速率为v(PCl3)="0.0032" mol·L-1·s-1
B.保持其他条件不变,若升高温度,平衡时,c(PCl3)="0.11" mol·L-1,则反应为放热反应
C. 相同温度下,若起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,则达平衡前v(正)>v(逆)
D.相同温度下,若起始时向容器中充入2.0molPCl3、2.0molCl2,则达平衡时,PCl3的转化率大于80%
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是
CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是
| A.当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态 |
| B.当平衡向正方向移动时,平衡常数一定增大 |
| C.增大压强,可提高CO2和H2的转化率 |
| D.相同条件下,2 mol氢原子所具有的能量等于1 mol氢分子所具有的能量 |
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-373.4kJ/mol
N2(g)+2CO2(g) △H=-373.4kJ/mol
反应达到平衡后,改变某一个条件,下列示意图曲线①?⑧中正确的是
| A.①⑥⑧ | B.①⑤⑦ | C.②③④ | D.③⑥⑦ |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应: SO2(g)+NO2(g) SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示。则正确的结论是
SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示。则正确的结论是
| A.逆反应速率:a点小于点c |
| B.反应物浓度:a点小于点b |
| C.反应在c点时SO2的转化率最大 |
| D.反应物的总能量低于生成物的总能量 |