题目内容
—定条件下,2SO2(g)+O2(g)  2SO3(g) ΔH<0。下列有关叙述正确的是
2SO3(g) ΔH<0。下列有关叙述正确的是
| A.升髙温度,v正变大,v逆变小 |
| B.恒温恒容,充入O2,O2的转化率升高 |
| C.恒温恒压,充人N2,平衡不移动 |
| D.恒温恒容,平衡前后混合气体的密度保持不变 |
D
解析试题分析:A、升高温度,正逆反应速率均增大,平衡逆向移动,错误;B、通入氧气,平衡正向移动,SO2的转化率升高,O2的转化率降低,错误;C、恒压,充入氮气,体积增大,相当于压强减小,平衡逆向移动,错误;D、ρ=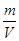 ,m、V均不变,故密度不变,正确。
,m、V均不变,故密度不变,正确。
考点:考查化学反应和影响化学平衡移动的因素。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
将H2和Br2充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g) 2HBr(g) △H<0;平衡时Br2的转化率为a,若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b,则a与b的关系是( )。
2HBr(g) △H<0;平衡时Br2的转化率为a,若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b,则a与b的关系是( )。
| A.a>b | B.a=b | C.a < b | D.无法确定 |
碘单质难溶于小却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq) I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是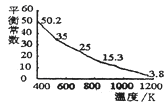
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
下列说法正确的是
| A.增大体系压强,活化分子数增加,化学反应速率一定增大 |
| B.加入反应物,使活化分子百分数增加,化学反应速率增大 |
| C.活化分子间所发生的分子间的碰撞均为有效碰撞 |
| D.升高温度,活化分子百分数增加,化学反应速率一定增大 |
下列关于O2+2SO2 2 SO3的叙述错误的是
2 SO3的叙述错误的是
| A.增加O2的浓度能加快反应速率 |
| B.若O2足量,则SO2可以完全转化为SO3 |
| C.加入催化剂能加快反应速率 |
| D.升高体系温度能加快反应速率 |
2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A.0.40 mol | B.0.20 mol |
| C.小于0.20 mol | D.大于0.20 mol,小于0.40 mol |
在一密闭容器中发生可逆反应2A(g)+B(g)  2C(g),下表为反应在不同压强和温度下物质A的平衡转化率,有关说法正确的是( )
2C(g),下表为反应在不同压强和温度下物质A的平衡转化率,有关说法正确的是( )
 A转化率 压强 A转化率 压强温度 | P1(Mpa) | P2(Mpa) |
| 400℃ | 99.6% | 99.7% |
| 500℃ | 96.9% | 97.8% |
A.物质B可以是气态,也可以是非气态
B.P1>P2
C.该反应为吸热反应
D.若反应在恒压为B,初始温度为400℃下的绝热密闭容器中进行,平衡时A的转化率小于0.996
Ⅰ.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g) H2(g)+CO2(g),反应过程中测定的部分数据见下表:
H2(g)+CO2(g),反应过程中测定的部分数据见下表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |
①反应在2 min内的平均速率为v(H2O)=___________;
②800℃时,化学平衡常数K的值为_______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率______(填“增大”或“减小”或“不变”)。
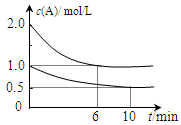
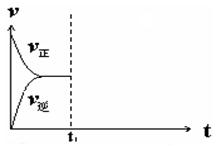
④在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在右图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。
Ⅱ.实验室中利用复分解反应制取Mg(OH)2。实验数据和现象如下表所示(溶液体积均取用1mL):
| 组别 | 药品1 | 药品2 | 实验现象 |
| I | 0.01 mol/L NaOH溶液 | 0.01 mol/L MgCl2溶液 | 生成白色沉淀 |
| II | 0.01 mol/L氨水 | 0.01 mol/L MgCl2溶液 | 无现象 |
| III | 0.1 mol/L氨水 | 0.1 mol/L MgCl2溶液 | 现象III |
| IV | 0.1 mol/L氨水 | 0.01 mol/L MgCl2溶液 | 生成白色沉淀 |
| V | 0.01 mol/L氨水 | 0.1 mol/L MgCl2溶液 | 无现象 |
①现象III是 ;
②如果向0.028 mol/L的MgCl2溶液中加入等体积的NaOH溶液,请计算NaOH溶液的浓度至少达到
mol/L时,溶液中开始出现白色沉淀(Ksp(Mg(OH)2)= 5.6×10-12)。
③MgCl2溶液和氨水混合后存在下列化学平衡:Mg2+(aq) + 2NH3·H2O(aq)
 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。  xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是