题目内容
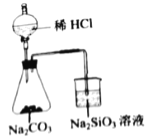
【题目】废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:

已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
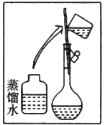
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。

【答案】(1)2MnOOH+C ![]() 2MnO+CO↑+H2O↑ 反应过程中产生氯气,造成环境污染 加快酸浸时的反应速率 C、 Fe(OH)3 先将Fe2+氧化成Fe3+,再调节pH使Fe3+沉淀完全 3≤pH<5.5 阳 C6H12O6-2e-=C6H10O6+2H+
2MnO+CO↑+H2O↑ 反应过程中产生氯气,造成环境污染 加快酸浸时的反应速率 C、 Fe(OH)3 先将Fe2+氧化成Fe3+,再调节pH使Fe3+沉淀完全 3≤pH<5.5 阳 C6H12O6-2e-=C6H10O6+2H+
【解析】
废料中加入过量的炭黑,还原焙烧,锰元素变成二价锰离子,酸浸时得到锰离子、锌离子和亚铁离子,过量的碳黑不溶于酸,过滤变成滤渣1,溶液中需要除去亚铁离子,利用表格数据,应将亚铁离子氧化为铁离子以氢氧化铁沉淀形成分离除去,但是需要注意二价锰离子在酸性条件下比较稳定,pH高于5.5时易被O2氧化,所以应先通入氧气,后加入碳酸锰调节溶液的pH值并控制二价锰离子不被氧化。最后通过电解,锌离子得到电子在阴极生成锌,二价锰离子在阳极失去电子生成二氧化锰。
(1)MnOOH与炭黑反应,锰元素被还原为MnO ,因为碳过量时生成一氧化碳,方程式为:2MnOOH+C ![]() 2MnO+CO↑+H2O↑,二氧化锰和浓盐酸反应生成氯气,造成环境污染。
2MnO+CO↑+H2O↑,二氧化锰和浓盐酸反应生成氯气,造成环境污染。
(2)加热和搅拌都可以加快酸浸时的反应速率,碳不溶于水或酸,所以滤渣1为碳,溶液中通入氧气和加入碳酸锰,使铁元素变成Fe(OH)3沉淀而分离。
(3)实验过程中需要将亚铁离子氧化并沉淀,但不能将锰元素氧化和沉淀,因为二价锰在酸性条件下很稳定,所以先通入氧气,先将Fe2+氧化成Fe3+,再调节pH使Fe3+沉淀完全,当铁离子浓度小于或等于10-5mol/L时认为完全沉淀,假设此时溶液中的氢氧根离子浓度为xmol/L,则有10-5×x3=10-38,解x=10-11mol/L,则溶液的pH为3,溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,形成Mn(OH)2沉淀时的氢氧根离子浓度为ymol/L,则有0.1×y2=10-13,形成Zn (OH)2沉淀时的氢氧根离子浓度为zmol/L,0.1×z2=10-17,y=10-6 mol/L,z=10-8 mol/L,对应的pH分别为8和6,且Mn2+在pH高于5.5时易被O2氧化,所以应调节pH范围为3≤pH<5.5。
(4)电解过程中锰元素化合价升高,在阳极生成二氧化锰。
(5)二氧化锰做氧化剂,得到电子,在正极反应,则葡萄糖失去电子,电极反应为:C6H12O6-2e-=C6H10O6+2H+。

 名校课堂系列答案
名校课堂系列答案【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离常数 | 1.7×10-5 | K1=4.3×10-7,K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填序号),一定不变的是________(填序号)。一定变大的是________(填序号),
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E. c(CH3COO-)·c(H+)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是____________(填序号)。