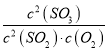题目内容
【题目】将32.0 g铜与250 mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。(假定反应前后溶液体积不变,也不考虑N2O4的存在。)
试计算:
(1)硝酸的物质的量浓度是____________ molL-1
(2)若要使此混合气体被水完全吸收,需要通入标准状况下__________L O2。
【答案】6 5.6
【解析】
32.0 g铜的物质的量为![]() =0.5mol,11.2 L混合气体的物质的量为
=0.5mol,11.2 L混合气体的物质的量为![]() =0.5mol,设产生NO为xmol,NO2为ymol,由NO和NO2混合气体在标准状况下的体积为11.2 L可得x+y=0.5mol①,由得失电子数目守恒可得3x+y=1mol②,解联立方程可得x=0.25mol,y=0.25mol。
=0.5mol,设产生NO为xmol,NO2为ymol,由NO和NO2混合气体在标准状况下的体积为11.2 L可得x+y=0.5mol①,由得失电子数目守恒可得3x+y=1mol②,解联立方程可得x=0.25mol,y=0.25mol。
(1)由N原子个数守恒可得,n(HNO3)=n(NO)+n(NO2)+n(NO3—)=0.25mol+0.25mol+0.5mol×2=1.5mol,则硝酸的物质的量浓度是![]() =6 molL-1,故答案为:6;
=6 molL-1,故答案为:6;
(2)由得失电子数目守恒可知,混合气体被水完全吸收时,4 n(O2)= 3n(NO)+n(NO2)=3×0.25mol+1×0.25mol=1mol,则n(O2)=0.25mol,V (O2)=0.25mol×22.4L/mol=5.6L,故答案为:5.6.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
实验编号 试剂 | A | B | C |
10% H2O2/mL | 20.0 | V1 | V2 |
2 mol·L-1 FeCl3/ mL | 0 | 5.0 | 10.0 |
H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
(1)欲用图装置来比较该反应的反应速率快慢,检查该装置气密性的方法是_______。

(2)当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测____________________推(计)算反应速率。
(3)为实现实验目的,则V4=____。
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 =2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:___________________。
(5)读数时发现,量气装置左端液面低于右端液面,则测得的气体体积_____填“偏大”、“偏小”或“无影响”)