题目内容
X、Y、Z为三种短周期元素,他们在周期表中的位置关系如图所示.据此回答下列问题:(1)X元素的名称为______,它形成的单质为______(用分子式表示).若该元素的某种原子内核内中子数与质子数相等,则该原子的摩尔质量是______;结合最近卫星发回的图片预测,月球的土壤中吸附着数百万吨的23He,上述原子与23He的关系是______.
(2)Y元素形成单质的电子式是______,Y单质的氧化性______(填“强于”或者“弱于”)O2的氧化性,并用相应的化学方程式说明______.
(3)元素Z在自然界中的存在形态为______(填序号)①只有化合态,②只有游离态,③既有游离态,又有化合态;含Z元素的某些化合物燃烧后会造成严重的大气污染,其主要原因是______.
(4)Y元素、Z元素与H2化合时的能量变化是______,(填“都放热”、“都吸热”、“前者放热,后者吸热”或者“前者吸热,后者放热”),能量变化的大小关系为前者______(填“>”、“=”或者“<”).
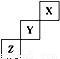
【答案】分析:短周期元素应是周期表前三周期元素,则X位于第一周期,应为He,Y为F,Z为S,
He只能形成单原子分子,
质子数相同、中子数不同的两种原子互为同位素,
火山口附近存在单质S,S元素燃烧后生成污染性气体SO2;
元素的非金属性越强,生成的氢化物越稳定,放出的能量越多.
解答:解:短周期元素应是周期表前三周期元素,则X位于第一周期,应为He,以此类推,Y为F,Z为S,
(1)X为He,He只能形成单原子分子,氦的质子数为2,该元素的某种原子内核内中子数与质子数相等,则该原子的质量数为4,在数值上和该原子的摩尔质量相等,则该原子的摩尔质量是4g/mol,24He与23He质子数相同、中子数不同,互为同位素,
故答案为:氦;He;4g/mol;同位素;
(2)Y为F,最外层有7各电子,形成单质的电子式是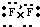 ,根据同周期元素从左到右元素的非金属逐渐增强可知,F的非金属性大于O,一般来说,元素的非金属性越强,对应的单质的氧化性越强,如在2F2+2H2O=4HF+O2↑反应中,F2的氧化性大于O2的氧化性,
,根据同周期元素从左到右元素的非金属逐渐增强可知,F的非金属性大于O,一般来说,元素的非金属性越强,对应的单质的氧化性越强,如在2F2+2H2O=4HF+O2↑反应中,F2的氧化性大于O2的氧化性,
故答案为: ;强于;2F2+2H2O=4HF+O2↑;
;强于;2F2+2H2O=4HF+O2↑;
(3)火山口附近存在单质S,含S元素燃烧后生成污染性气体SO2,是形成酸雨的主要污染物,
故答案为:③;含S的某些化合物燃烧后生成SO2,会形成酸雨,危害环境;
(4)化合反应都是放热反应,元素的非金属性越强,生成的氢化物越稳定,放出的能量越多,
故答案为:都放热;>.
点评:本题考查位置结构性质的相互关系的应用,题目难度不大,本题注意根据元素所在位置推断元素的种类,注意元素的非金属性越强,生成的氢化物越稳定,放出的能量越多的特点.
He只能形成单原子分子,
质子数相同、中子数不同的两种原子互为同位素,
火山口附近存在单质S,S元素燃烧后生成污染性气体SO2;
元素的非金属性越强,生成的氢化物越稳定,放出的能量越多.
解答:解:短周期元素应是周期表前三周期元素,则X位于第一周期,应为He,以此类推,Y为F,Z为S,
(1)X为He,He只能形成单原子分子,氦的质子数为2,该元素的某种原子内核内中子数与质子数相等,则该原子的质量数为4,在数值上和该原子的摩尔质量相等,则该原子的摩尔质量是4g/mol,24He与23He质子数相同、中子数不同,互为同位素,
故答案为:氦;He;4g/mol;同位素;
(2)Y为F,最外层有7各电子,形成单质的电子式是
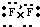 ,根据同周期元素从左到右元素的非金属逐渐增强可知,F的非金属性大于O,一般来说,元素的非金属性越强,对应的单质的氧化性越强,如在2F2+2H2O=4HF+O2↑反应中,F2的氧化性大于O2的氧化性,
,根据同周期元素从左到右元素的非金属逐渐增强可知,F的非金属性大于O,一般来说,元素的非金属性越强,对应的单质的氧化性越强,如在2F2+2H2O=4HF+O2↑反应中,F2的氧化性大于O2的氧化性,故答案为:
 ;强于;2F2+2H2O=4HF+O2↑;
;强于;2F2+2H2O=4HF+O2↑;(3)火山口附近存在单质S,含S元素燃烧后生成污染性气体SO2,是形成酸雨的主要污染物,
故答案为:③;含S的某些化合物燃烧后生成SO2,会形成酸雨,危害环境;
(4)化合反应都是放热反应,元素的非金属性越强,生成的氢化物越稳定,放出的能量越多,
故答案为:都放热;>.
点评:本题考查位置结构性质的相互关系的应用,题目难度不大,本题注意根据元素所在位置推断元素的种类,注意元素的非金属性越强,生成的氢化物越稳定,放出的能量越多的特点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目





