题目内容
下图是依各个原子的性质和原子序数(1~20)画的关系图,各图的纵轴可能代表下列的某一性质:质量数、质子数、最高正价、原子半径相对大小、得电子相对能力.图2中原子序数8、9和图3中原子序数2、10、18在纵轴上没有对应的数值.

(1)图1~图3的纵轴分别代表
(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中.B是生命体的构架元素,E是同周期中半径最小的元素,G的最外层电子数比次外层电子数少2个.它们的原子序数存在如下关系:①a+b=c,②
=c,③
=d,请根据提供的信息,回答下列问题:
①如图是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置;
②写出铜与C元素最高价氧化物对应水化物的浓溶液反应的化学 方程
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y-→Z+W.若X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,其相应的化学方程式为

(1)图1~图3的纵轴分别代表
质子数
质子数
、最高正价
最高正价
、得电子相对能力
得电子相对能力
;(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中.B是生命体的构架元素,E是同周期中半径最小的元素,G的最外层电子数比次外层电子数少2个.它们的原子序数存在如下关系:①a+b=c,②
| (b+d) |
| 2 |
| (c+e) |
| 2 |
①如图是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置;

②写出铜与C元素最高价氧化物对应水化物的浓溶液反应的化学 方程
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
;③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y-→Z+W.若X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,其相应的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
分析:(1)元素的质子数等于该元素的原子序数;
元素的最高正价等于最外层电子数,且O、F无最高正价,稀有气体化合价为0;
从图3中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小→大);
(2)B是生命体的构架元素,则B为碳元素;G的最外层电子数比次外层电子数少2个,则G为硫元素.元素分散在三个短周期中,A的原子序数小于B,则A处于第一周期,A为氢元素;原子序数c=a+b=1+6=7,则C为氮元素;
原子序数c=
,则d=2c-b=14-6=8,则D为氧元素;原子序数d=
,则e=2d-c=16-7=9,则E为氟元素,
①依据元素周期表的结构及元素原子的结构,把具体的元素符号填入周期表中;
②C元素最高价氧化物对应的水化物的浓溶液为浓HNO3,铜与浓硝酸反应生成硝酸铜、二氧化氮与水;
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y-→Z+W,X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,应是氨的催化氧化反应.
元素的最高正价等于最外层电子数,且O、F无最高正价,稀有气体化合价为0;
从图3中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小→大);
(2)B是生命体的构架元素,则B为碳元素;G的最外层电子数比次外层电子数少2个,则G为硫元素.元素分散在三个短周期中,A的原子序数小于B,则A处于第一周期,A为氢元素;原子序数c=a+b=1+6=7,则C为氮元素;
原子序数c=
| (b+d) |
| 2 |
| (c+e) |
| 2 |
①依据元素周期表的结构及元素原子的结构,把具体的元素符号填入周期表中;
②C元素最高价氧化物对应的水化物的浓溶液为浓HNO3,铜与浓硝酸反应生成硝酸铜、二氧化氮与水;
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y-→Z+W,X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,应是氨的催化氧化反应.
解答:解:(1)元素的质子数等于该元素的原子序数,故图1纵轴代表质子数;
元素的最高正价等于最外层电子数,且O、F无最高正价,稀有气体化合价为0,故图2纵轴代表最高正价;
从图3中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小→大),故图3纵轴代表得电子相对能力,
故答案为:质子数;最高正价;得电子相对能力;
(2)B是生命体的构架元素,则B为碳元素;G的最外层电子数比次外层电子数少2个,则G为硫元素.元素分散在三个短周期中,A的原子序数小于B,则A处于第一周期,A为氢元素;原子序数c=a+b=1+6=7,则C为氮元素;
原子序数c=
,则d=2c-b=14-6=8,则D为氧元素;原子序数d=
,则e=2d-c=16-7=9,则E为氟元素,
①依据元素周期表的结构及元素原子的结构,把具体的元素符号填入周期表中为: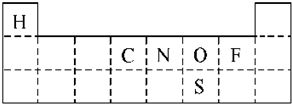 ,
,
故答案为: ;
;
②C元素最高价氧化物对应的水化物的浓溶液为浓HNO3,铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y-→Z+W,X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,应是氨的催化氧化反应,反应方程式为:4NH3+5O2
4NO+6H2O,
故答案为:4NH3+5O2
4NO+6H2O.
元素的最高正价等于最外层电子数,且O、F无最高正价,稀有气体化合价为0,故图2纵轴代表最高正价;
从图3中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小→大),故图3纵轴代表得电子相对能力,
故答案为:质子数;最高正价;得电子相对能力;
(2)B是生命体的构架元素,则B为碳元素;G的最外层电子数比次外层电子数少2个,则G为硫元素.元素分散在三个短周期中,A的原子序数小于B,则A处于第一周期,A为氢元素;原子序数c=a+b=1+6=7,则C为氮元素;
原子序数c=
| (b+d) |
| 2 |
| (c+e) |
| 2 |
①依据元素周期表的结构及元素原子的结构,把具体的元素符号填入周期表中为:
 ,
,故答案为:
 ;
;②C元素最高价氧化物对应的水化物的浓溶液为浓HNO3,铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y-→Z+W,X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,应是氨的催化氧化反应,反应方程式为:4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
点评:本题考查结构性质位置关系综合运用,难度中等,(1)注意根据元素周期律分析图象中纵坐标随横坐标的变化关系.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目