题目内容
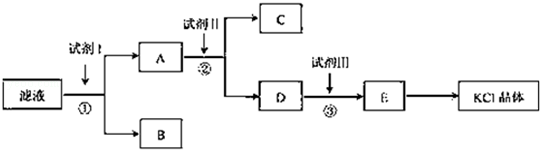
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图:回答下列问题: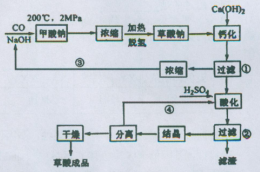
(1)CO和NaOH在一定条件下合成甲酸钠,甲酸钠加热脱氢的化学反应方程式分别为:____、____ 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是____ ;过滤操作②的滤液是 和 ,滤渣是____ 。
(3)工艺过程中③和④的目的是____ 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是___ 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMn04溶液滴定,至浅粉红色不消褪,消耗KMn04溶液15.00 mL,反应的离子方程式为____ ;
列式计算该成品的纯度 。

解析试题分析:⑴CO和NaOH在一定条件下合成甲酸钠的反应可用观察法将其配平;甲酸钠加热脱氢(产生H2),通过观察法并结合原子守恒得另一生成物为Na2C2O4。
⑵根据“钙化”反应:Na2C2O4+Ca(OH)2=CaC2O4↓+2NaOH,由此可确定过滤操作①的滤液是NaOH,滤渣是CaC2O4;根据“酸化”反应:CaC2O4+H2SO4=CaSO4+ H2C2O4,由此可确定过滤操作②的滤液是H2C2O4,滤渣是CaSO4;
⑶该工艺过程中③和④(“回头”)分别循环利用氢氧化钠和硫酸,减小污染,也可降低成本。
⑷若在甲酸钠脱氢后生成的Na2C2O4中直接用硫酸酸化制备草酸,会产生Na2SO4杂质。
⑸根据得失电子守恒有5C2O42-+2MnO4-――2Mn2++10CO2↑,再根据电荷守恒有5C2O42-+2MnO4-+16H+――2Mn2++10CO2↑,最后根据原子守恒得5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;最后根据该反应方程式建立关系式“5(H2C2O4·2H2O)~2KMnO4”,得该成品的纯度为: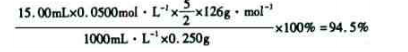 。
。
考点:本题以“草酸晶体的工业制备流程图”为素材考查反应方程式的书写与分析、物质的循环利用及化学计算。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案下列有关实验的结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 溶液中一定含有 |
| B | 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色气体 | 溶液中一定含有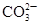 |
| C | 用酸度计测定SO2和CO2饱和溶液的pH,前者pH小 | H2SO3酸性强于H2CO3 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色 | 浓氨水呈碱性 |
为实现消除碘缺乏症的目标,常采取向食盐中加入含碘的物质。其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中IO3- 和I- 可发生反应:IO3-+ I-+6H+==3I2+3H2O。根据上述反应,可用试纸和一些生活中常见的物质进行实验,证明食盐中存在IO3-。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行上述实验时必须使用的物质是( )
| A.③⑥ | B.②④⑥ | C.①③ | D.①②④⑤⑦ |
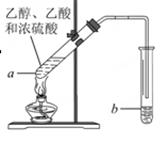
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原
理: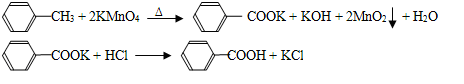
实验方法:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。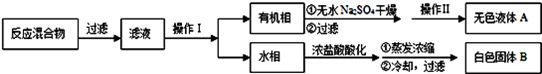
已知:苯甲酸相对分子质量122 ,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,需要用到的主要玻璃仪器为 ;操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中, 加热溶解, | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体, | | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220 g产品溶解在甲醇中配成100 ml溶液,移取2 5.00 ml溶液,滴定,消耗KOH的物质的量为2.40 × 10 -3 mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 。(保留两位有效数字)。