题目内容
【题目】近年来,我国(PCB)印刷电路板制造业发展迅速,总产值居世界第一。工业上常用CuCl2和盐酸的混合液作为蚀刻液,蚀刻PCB表面的铜箔。
已知:①一定条件下,Cu与Cu2+反应可生成+ 1价铜。
②氯化亚铜(CuCl)难溶于水,可与Cl-形成CuCl32-进入溶液。
Ⅰ.蚀刻过程中将Cu转化为CuCl32-去除。
(1)蚀刻过程的离子方程式有_______、CuCl+2Cl- ![]() CuCl32-。
CuCl32-。
(2)蚀刻液中的盐酸可大大提高蚀刻效率,结合上述反应解释原因:______________。
Ⅱ.蚀刻一段时间后,将蚀刻废液中的CuCl32-转化为Cu2+,即可再生循环利用,常用方法如下:
(1)化学再生:加入H2O2溶液可使蚀刻液再生,该反应的离子方程式是______________。
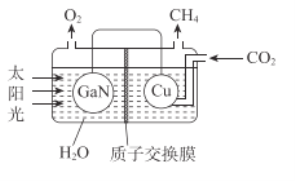
(2)电解再生(电极不参与反应):按下图装置,使蚀刻液再生并回收金属Cu。
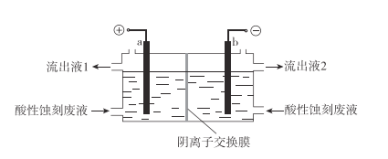
①在______极(填“a”或“b)”)回收得到金属Cu。
②结合电极反应解释阳极区蚀刻液再生的原理:________。
③实际电解过程中,通常在两极上均产生少量气体,则流出液1、流出液2混合后,还需补充试剂________,得到可循环使用的再生液。
④研究表明:其他条件不变,使用无膜电解槽再生时,一段时间后,电极上析出的Cu总量反而会随电解时间的増长而减少。解释Cu的总量减少的原因:________。
【答案】Cu2++Cu+2Cl﹣ =2CuCl 盐酸可溶解覆盖在Cu表面的CuCl,促进蚀刻Cu 2CuCl32-+H2O2 +2H+ = 2Cu2+ +6Cl﹣+2H2O b 阳极发生反应:CuCl32-- e﹣=Cu2+ + 3Cl﹣,阴极区的Cl﹣通过阴离子交换膜进入阳极区,使蚀刻废液再生 HCl 阳极生成的Cu2+移向阴极,使电极上析出的Cu溶解
【解析】
I.(1)从题给的信息来看,工业上用CuCl2和盐酸的混合液作为蚀刻液,蚀刻过程分为两个阶段,第一阶段是生成CuCl沉淀,第二阶段是CuCl溶于过量的Cl-形成CuCl32-进入溶液。题目已给了第二阶段的离子方程式,所以第一阶段的反应应是生成CuCl阶段:Cu2+ +Cu+2Cl-=2CuCl,注意CuCl作为难溶物不拆写。
(2)盐酸提供了更多的Cl-,可加速溶解覆盖在铜表面的CuCl,使铜与Cu2+继续充分接触反应。
II.(1)收集题给信息:反应微粒有CuCl32- 和 H2O2,过氧化氢的作用就是将+1价Cu氧化为+2价Cu,此时配离子中的氯变为氯离子,考虑酸性介质,配平即可:2CuCl32-+H2O2+2H+ =2Cu2++6Cl-+2H2O。
(2)①电解的过程,在阴极产生铜单质,所以答案为b极;②阳极发生反应,实现了Cu元素的化合价由+1价变为+2价:CuCl32--e﹣= Cu2+ + 3Cl﹣,阴极区的Cl-通过阴离子交换膜进入阳极区,使蚀刻废液再生;③据题意,两极放出的少量气体,阴极为H2,阳极为Cl2,所以一段时间后补充一定的HCl气体即可;④没有了阴离子交换膜的阻挡,阳极生成的Cu2+会大量移向阴极,使电极上析出的Cu在Cu2+、Cl-存在的条件下再次溶解,故生成铜的质量减少。

 阅读快车系列答案
阅读快车系列答案【题目】探究0.5mol/L FeCl3溶液(pH=1)与不同金属反应时的多样性的原因。 (各组实验中:所用FeCl3溶液体积相同;金属过量;静置、不振荡)
实验 | 金属 | 现象及产物检验 |
I | 镁条 | 立即产生大量气体;金属表面变黑,该黑色固体能被磁铁吸引;液体颜 色由棕黄色逐渐变为红褐色;片刻后气泡减少;金属表面覆盖有红褐色沉淀,此时取反应后的液体, 滴加K3[Fe(CN)6]溶液,生成蓝色沉淀。 |
II | 铜粉 | 无气体产生;溶液逐渐变为蓝绿色;取反应后的溶液,滴加K3[Fe(CN)6]溶液,生成蓝色沉淀。 |
(1)根据实验I的现象,推测红褐色液体为胶体,并用光束照射该液体,在与光束垂直的方向观察到_________得以证实。
(2)已知Fe和Fe3O4均能被磁铁吸引。
①为了确定黑色固体的成分是否含有Fe和Fe3O4,重复实验I,及时取少量镁条表面生成的黑色粉末,洗净后进行实验如下:
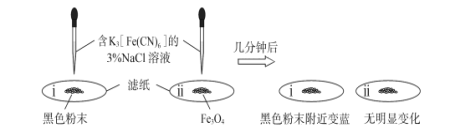
该实验说明黑色固体中一定含有_________,结合现象写出判断的理由_________。
②除上述结论外,分析实验I的现象,可知被还原得到的产物一定还有_________。
(3)实验Ⅰ、Ⅱ现象的差异,与Fe3+、Mg2+、Fe2+、H+、Cu2+的氧化性强弱有关,其顺序是Mg2+<Fe2+<_________。
(4)继续研究0.5mol/L FeCl3溶液(pH=1)与Fe的反应。
实验 | 金属 | 现象及产物检验 |
Ⅲ | 铁粉 | 持续产生少量气体;一段时间后,溶液颜色变浅,底部有红褐色沉 淀,经检验,溶液pH=4;含有Fe2+,无Fe3+。 |
Ⅳ | 铁丝 | 无明显的气泡产生;一段时间后,溶液变为浅绿色,经检验,溶液 pH=2,含有Fe2+和Fe3+;Fe3+被还原的量多于实验Ⅲ。 |
①实验Ⅲ中发生反应的离子方程式有_________。
②已知:相同条件下,H+在溶液中的移动速率远大于Fe3+。 结合实验I、Ⅱ,由反应中金属表面离子浓度的变化,推测实验III、IV现象差异的原因:_________。