题目内容
【题目】现用 0.1000mol/L KMnO4 酸性溶液滴定未知浓度的无色 H2C2O4 溶液(体积为 20.00mL)。请回答下列问题
(1)该反应的离子方程式是___________________。
(2)盛放高锰酸钾溶液的是___ (填“酸式”或“碱式”)滴定管,其原因是___________________。
(3)滴定终点的现象为______。
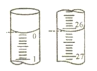
(4)若某次滴定开始和结束时,滴定管中的液面如图所示,则终点的读数为___mL。小明同学根据 3 次实验求得平均消耗高锰酸钾溶液的体积为 VmL,请计算该 H2C2O4溶液的物质的量浓度为___mol/L
(5)下列操作使测定结果偏低的是___(填字母)。
A.酸式滴定管未用标准液润洗直接注入 KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取 KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
【答案】![]() 酸式 KMnO4溶液会把碱式滴定管的橡胶管氧化 当滴入最后一滴标准液时,溶液由无色变为紫红色,且半分钟内不褪色 26.10 0.0125V或V/80 CD
酸式 KMnO4溶液会把碱式滴定管的橡胶管氧化 当滴入最后一滴标准液时,溶液由无色变为紫红色,且半分钟内不褪色 26.10 0.0125V或V/80 CD
【解析】
(1) KMnO4 酸性溶液和H2C2O4发生氧化还原反应,KMnO4被还原为Mn2+,H2C2O4被氧化为CO2;
(2) 酸性高锰酸钾具有强氧化性,实验时应用酸式滴定管;高锰酸钾具有强氧化性,能腐蚀碱式滴定管下端橡胶管;
(3) 高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液应该是由无色变为浅紫色;
(4) 根据滴定管的结构和精确度读出滴定管中的读数;利用关系式:2MnO4-~5H2C2O4计算H2C2O4的物质的量浓度;
(5)根据c(待测)=c(标准)×![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差。
分析不当操作对V(标准)的影响,以此判断浓度的误差。
(1) KMnO4 酸性溶液和H2C2O4发生氧化还原反应,KMnO4被还原为Mn2+,H2C2O4被氧化为CO2,反应的离子方程式是2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
因此,本题正确答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2) 氧化还原滴定,盛装高锰酸钾用酸式滴定管;由于KMnO4具有强氧化性,能腐蚀橡胶管,故不能用碱式滴定管盛放KMnO4溶液;
因此,本题正确答案为:酸式;KMnO4溶液会把碱式滴定管的橡胶管氧化;
(3) MnO4-为紫色,Mn2+为无色,当滴入最后一滴标准液时,溶液从无色变成紫红色,且半分钟内保持不变色;
因此,本题正确答案为:当滴入最后一滴标准液时,溶液由无色变为紫红色,且半分钟内不褪色;
(4) 视线与凹液面最低处相切,故起始读数为0.00mL,终点读数为26.10mL;
根据关系式:2MnO4-~5H2C2O4,H2C2O4溶液的物质的量等于高锰酸钾的2.5倍,
c(H2C2O4)= ![]() =0.0125V;
=0.0125V;
因此,本题正确答案为:0.0125V;
(5)A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液,浓度偏低,结果偏高,不选A;
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥,不影响,不选B;
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡,所用高锰酸钾过少,结果偏低,选C;
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数,结果偏低,选D。
因此,本题正确答案为:CD。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】为达到实验目的,试剂或仪器或操作正确的是( )
选项 | 实验目的 | 试剂或仪器或操作 |
A | 测定中和热 | 选择浓硫酸与NaOH溶液作为试剂 |
B | 比较Cl与S的非金属性 | 将盐酸滴入 |
C | 制备氢氧化铁胶体 | 将氯化铁饱和溶液滴入沸水中,加热到红褐色 |
D | 电解法制取氯气 | 用铁作阳极电解饱和食盐水 |
A. AB. BC. CD. D