题目内容
【题目】研究表明:丰富的 CO2 可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由 CO2累积所产生的温室效应,实现 CO2的良性循环。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.3kJ/mol
CO(g)+H2O(g)△H=+41.3kJ/mol
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g)△H=-210.5kJ/mol
C2H4(g)+2H2O(g)△H=-210.5kJ/mol
①CO2加氢合成乙烯的热化学方程式为___。
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高 CO2 的转化率,可以采取的措施是___(填字母)。
A.减小压强 B.增大 H2浓度 C.加入合适的催化剂 D.分离出水蒸气
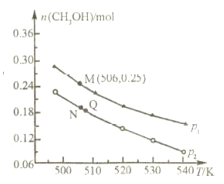
(2)另一种方法是将 CO2 和 H2 在 230℃催化剂条件下生成甲醇蒸气和水蒸气,在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示。若在 10L 恒容密闭容器中投入1molCO2 和 2.75molH2,发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①能判断该反应达到化学平衡状态的是___(填字母)。
A.c(H2):c(CH3OH)=3:1
B.容器内氢气的体积分数不再改变
C.容器内气体的密度不再改变
D.容器内压强不再改变
②上述反应的△H___0(填“>”或“<”),图中压强 p1 ___p2(填“>”或“<”)。
③经测定知 Q 点时容器的压强是反应前压强的 9/10,则 Q 点 CO2的转化率为___。
④M 点时,该反应的平衡常数 K=___ (计算结果保留两位小数)。
(3)用生石灰吸收 CO2 可生成难溶电解质 CaCO3,其溶度积常数 Ksp=2.8×10-9。现有一物质的量浓度为2×10-4mol/L 纯碱溶液,将其与等体积的 CaCl2溶液混合,则生成沉淀所需 CaCl2溶液的最小浓度为___mol/L。
【答案】2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H=-127.9kJ/mol B BD < > 18.75% 1.04 5.6×10-5
C2H4(g)+4H2O(g)△H=-127.9kJ/mol B BD < > 18.75% 1.04 5.6×10-5
【解析】
(1) ①根据盖斯定律计算;
②要加快反应速率并提高 CO2 的转化率,可以增大反应物H2的浓度,使平衡右移;
(2)①根据达到平衡状态时正反应速率等于逆反应速率,混合物中各组分百分含量保持不变以及相关量不变分析判断;
②由图可以知道,压强一定时,温度越高,CH3OH的物质的量越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应;
正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大;
③列出三段式,根据压强是反应前压强的 9/10,列方程计算;
④温度不变平衡常数不变,图中M 点时,容器体积为10L,结合M点的坐标可以知道,M点的CH3OH的物质的量为0.25mol,根据反应,列出三段式,再根据 K=![]() 计算;
计算;
(3)因Qc![]() Ksp时,形成沉淀,计算c(Ca2+)。
Ksp时,形成沉淀,计算c(Ca2+)。
(1) ①已知:I.CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.3kJ/mol
CO(g)+H2O(g)△H=+41.3kJ/mol
II.2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g)△H=-210.5kJ/mol
C2H4(g)+2H2O(g)△H=-210.5kJ/mol
根据盖斯定律,I![]() 2+II可得:2CO2(g)+6H2(g)
2+II可得:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H=-127.9kJ/mol,
C2H4(g)+4H2O(g)△H=-127.9kJ/mol,
因此,本题正确答案是:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H=-127.9kJ/mol;
C2H4(g)+4H2O(g)△H=-127.9kJ/mol;
②A.正反应为气体体积减小的反应,低压有利于逆向进行,CO2的转化率减小,故A错误;
B.增大 H2浓度,平衡正向移动,CO2的转化率增大,故B正确;
C.加入合适的催化剂,可以加快反应速率,但不影响平衡移动,CO2的转化率不变,故C错误;
D.分离出水蒸气,生成物浓度减小,平衡正向移动,CO2的转化率增大,但反应速率减小,故D错误。
因此,本题正确答案是:B;
(2)①A.c(H2):c(CH3OH)=3:1不能说明反应到平衡;
B.容器内氢气的体积分数不再改变,说明混合物中各组分百分含量不变,达到平衡;
C. 气体的总质量随着反应不变,所以容器内气体的密度一直不变,密度不变不能说明反应到平衡;
D. 由于气体总物质的量改变,容器内压强改变,所以压强不变说明已达平衡。
故选BD;
②由图可以知道,压强一定时,温度越高,CH3OH的物质的量越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应;
正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大,故压强p1 >p2。
因此,本题正确答案是:<;>。
③根据反应 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始(mol/L)0.1 0.275 0 0
转化(mol/L) x 3x x x
平衡(mol/L)0.1-x 0.275-3x x x
根据压强是反应前压强的 9/10,可以列出表达式![]() =
=![]() ,可以计算出x=0.01875,
,可以计算出x=0.01875,
即 CO2的转化率=![]() 100%=18.75%,
100%=18.75%,
因此,本题正确答案是:18.75%;
④温度不变平衡常数不变,图中M 点时,容器体积为10L,结合M点的坐标可以知道,M点的CH3OH的物质的量为0.25mol,
根据反应 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始(mol/L)0.1 0.275 0 0
转化(mol/L)0.025 0.075 0.025 0.025
平衡(mol/L)0.075 0.2 0.025 0.025
K=![]() =
=![]() =1.04,
=1.04,
因此,本题正确答案是:1.04;
(3)因Qc![]() Ksp时,形成沉淀,c(Ca2+)
Ksp时,形成沉淀,c(Ca2+)![]() mol/L=2.8
mol/L=2.8![]() 10-5mol/L,等体积混合前CaCl2溶液的物质的量浓度最小为5.6×10-5mol/L。
10-5mol/L,等体积混合前CaCl2溶液的物质的量浓度最小为5.6×10-5mol/L。
因此,本题正确答案是:5.6×10-5。

【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:
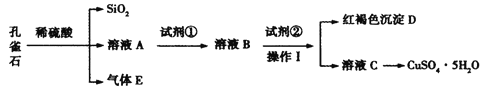
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe(OH)3 | 2.2 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:___(写一种)。
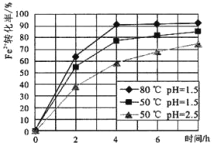
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是___。根据如图有关数据,你认为工业上氧化操作时应采取的条件是___。
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___范围。操作Ⅰ的名称是___。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是___、___、过滤、洗涤、干燥。
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度