题目内容
【题目】某化学兴趣小组为探究物质结构与性质之间的关系和元素性质的递变规律,设计了如下系列实验。回答下列问题:
I.NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低, 解释原因正确的是 (__________)
A.是因为NaNH2比NaOH 的相对分子质量小,前者分子间作用力小。
B.NaOH存在分子间氢键
C.NaNH2、NaOH均是离子化合物,其熔沸点高低与离子键的强弱有关,阴、阳离子电荷数越高,离子半径越小,离子键强度越大(或离子晶体的晶格能越大),则熔点越高。由于原子半径N>O,且NH2- 比OH- 原子个数多,则NH2- 比OH- 离子半径大,所以NaNH2比NaOH离子晶体的晶格能小,其熔点低。
D.N和O均处于第二周期,N在左方,同周期元素从左到右,元素的非金属性增强,其氢化物水溶液的酸性H2O>NH3,则碱性NaNH2>NaOH
II.根据下图所示装置回答以下问题。
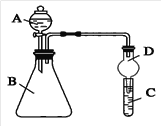
(1)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证Cl的非金属性大于S:锥形瓶中发生反应的离子方程式为_________________________。试管中的实验现象为___________________________。
(2)若要用此装置证明非金属性: N>C>Si,从以下所给物质中选出实验所要用到物质:
①稀HNO3溶液 ②稀硫酸溶液 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
试剂A与C分别对应为_________________(填数字序号)。
有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为发生干扰的化学方程式为:_______________________________。
【答案】C 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 溶液中产生淡黄色沉淀 ①、④ 2H++ SiO32-=H2SiO3↓
【解析】
I.NaNH2、NaOH均是离子化合物,其熔沸点高低与离子键的强弱有关,阴、阳离子电荷数越高,离子半径越小,离子键强度越大(或离子晶体的晶格能越大),则熔点越高。由于原子半径N>O,且NH2- 比OH- 原子个数多,则NH2- 比OH- 离子半径大,所以NaNH2比NaOH离子晶体的晶格能小,其熔点低。答案选C;
II.(1)利用Cl2能与Na2S反应,置换出S,可证明Cl元素的非金属性大于S元素的非金属性,则A与B中试剂反应制取Cl2,则A中所装药品浓盐酸,因为A与B的反应没有加热,所以B中所装药品为KMnO4,装置C中发生的反应是Cl2与Na2S的置换反应,所以C中药品是Na2S,锥形瓶中发生反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;试管中的实验现象为:溶液中产生淡黄色沉淀;
(2)若要用此装置证明非金属性:N>C>Si,可根据强酸制强酸的原理,利用稀硝酸溶解碳酸钙,将生成的CO2通入硅酸钠溶液中即可推断酸性的弱顺序为:HNO3>H2CO3>H2SiO3,进而得出非金属性强弱顺序,即A为稀硝酸、B为碳酸钙、C为硅酸钠溶液,因硝酸有挥发性,生成的CO2气体中混有硝酸蒸气,需要除去,否则会干扰碳酸与硅酸的强弱比较,方程式为2H++ SiO32-=H2SiO3↓。

【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=_________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)为加快反应速率,可以采取的措施是_______
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3



