题目内容
核电荷数小于l8的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),
原子核内质子数为(2n2一1)。下列关于元素X的说法中,不正确的是( )
| A.其最高化合价一定为+5 | B.可以形成化学式为KXO3的盐 |
| C.其氢化物可以用来做喷泉实验 | D.其最高价氧化物的水化物是强酸 |
A
解析试题分析:核电荷数小于l8的某元素X,其原子的电子层数为n,则1<n≤3,最外层电子数为(2n+1),最外层电子数小于8,原子核内质子数为(2n2-1),当n=2时,核内质子数是7,最外层电子数是5,符合条件,为N元素;如果n=3,核内质子数是17,最外层电子数是7,为Cl元素,符合条件,所以X可能是N或Cl元素。A、如果X是N元素,其最高正化合价为+5,如果是Cl元素,其最高正价为+7,错误;B、N或Cl元素都可以形成化学式为KXO3的盐,如KNO3或KClO3,正确;C、氨气或氯化氢都极易溶于水,所以都可以做喷泉实验,正确;D、硝酸和高氯酸都是强酸,所以N或Cl元素的最高价氧化物的水化物是强酸,正确。
考点:本题考查原子结构和元素周期律。

下列关于碱金属元素和卤素的说法中,错误的是( )
| A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 |
| B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强 |
| C.钾与水的反应比钠与水的反应更剧烈 |
| D.溴单质与水的反应比氯单质与水的反应更剧烈 |
根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W做电极组成的原电池,电极反应为W2++2e- =W,Y-2e- =Y2+。可知X、Y、W、Z的还原性由强到弱的顺序是
| A.X>Z>Y>W | B.Z>W>X>Y | C.Z>X>Y>W | D.Z>Y>X>W |
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成1HmX分子,在a g 1HmX中所含质子的物质的量是
A.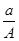 (A-N+m)mol (A-N+m)mol | B.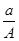 (A-N)mol (A-N)mol |
C.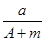 (A-N)mol (A-N)mol | D.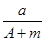 (A-N+m)mol (A-N+m)mol |
原计划实现全球卫星通讯需发射77颗卫星,这一数字与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”.已知铱的一种同位素的质量数为191,则其核内的中子数与质子数之差是
| A.77 | B.114 | C.37 | D.268 |
下列元素中,最高正化合价数值最大的是
| A.Na | B.P | C.C1 | D.C |
决定原子种类的因素是
| A.质子数和中子数 | B.质子数 | C.电子数 | D.质子数和电子数 |
下列叙述中错误的是 ( )
| A.原子半径Cl>S>O | B.还原性Na>Mg>Al |
| C.稳定性HF>HCl>HBr | D.酸性HClO4>H2SO4>H3PO4 |