题目内容
(6分)由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。

(1)关于该反应的下列说法中,正确的是_______。
(2)该图中能量的最高点和最低点之间的差值代表
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2) _________mol·L-1·min-1。
 CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
(1)关于该反应的下列说法中,正确的是_______。
| A.△H>0,△S>0; | B.△H>0,△S<0; | C.△H<0,△S<0; | D.△H<0,△S>0。 |
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2) _________mol·L-1·min-1。

(1)C 逆反应的活化能,0.225(各2分)
(1)根据图像可知,反应物的总能量高于生成物的总能量,所以是放热反应,即△H<0。根据方程式可知熵值是减小的,即△S<0,答案选C。
(2)根据图像可知,图中能量的最高点和最低点之间的差值代表的应该是逆反应的活化能。
(3)根据图像可知,反应进行到10min时反应达到平衡状态,此时生成甲醇是0.75mol/L,所以消耗氢气是2.25mol/L,所以氢气的反应速率是2.25mol/L÷10min=0.225mol·L-1·min-1。
(2)根据图像可知,图中能量的最高点和最低点之间的差值代表的应该是逆反应的活化能。
(3)根据图像可知,反应进行到10min时反应达到平衡状态,此时生成甲醇是0.75mol/L,所以消耗氢气是2.25mol/L,所以氢气的反应速率是2.25mol/L÷10min=0.225mol·L-1·min-1。

练习册系列答案
相关题目
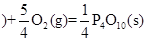 △H = —738.5kJ?mol-1
△H = —738.5kJ?mol-1