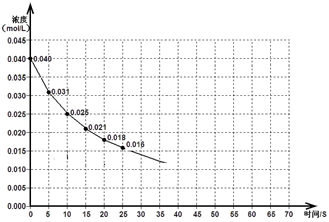题目内容
某容积可变的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)  2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是
2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是

 2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是
2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是
| A.30min时降低温度,40min时升高温度 |
| B.40min~54min之间反应速率v(正) < v(逆) |
| C.设20min和30min时的平衡常数分别为K1和K2,则K1 >K2 |
| D.0~8minA的平均反应速率为0.64mol/(L·min) |
B
试题分析:A、由图象知,降低温度平衡向正反应方向移动,平衡时C的量应该增加与图像不符,故A错误;B、该时间段平衡应该逆向移动,应该是v(正) < v(逆),故B正确;C.则K1 <K2故C错误.D、0~8minA的平均反应速率为(2-1.36)/8=0.08mol/(L·min),故D错误.故选B.

练习册系列答案
相关题目
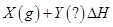 ,在
,在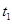 时刻反应达到平衡,在
时刻反应达到平衡,在 时刻缩小容器体积,
时刻缩小容器体积,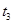 时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是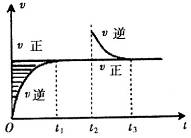
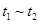 时间段与
时间段与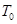 以上自发进行,则该反应的平衡常K随温度升高而增大
以上自发进行,则该反应的平衡常K随温度升高而增大 xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是  xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白: Ni(CO)4(g) ΔH < 0
Ni(CO)4(g) ΔH < 0 Ni(纯,s)+4CO(g) ΔH > 0
Ni(纯,s)+4CO(g) ΔH > 0 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表: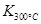 >
> ,则该反应是 热反应。
,则该反应是 热反应。
 FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g) 
 CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1) N2O3(g) ΔH<0
N2O3(g) ΔH<0