题目内容
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K= 。
已知: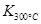 >
>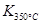 ,则该反应是 热反应。
,则该反应是 热反应。
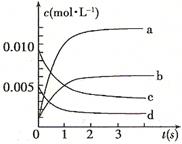
(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知:
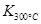 >
>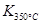 ,则该反应是 热反应。
,则该反应是 热反应。(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。

(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(1)K=
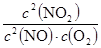 (1分) 放热 (1分)
(1分) 放热 (1分)(2)b (1分) 1.5×10-3mol/(L·s)(2分)
(3)bc (2分) (4)c (1分)
试题分析:(1)根据平衡常数的定义可写成平衡常数的表达式;因为
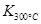 >
>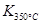 ,说明温度升高,平衡向逆反应方向移动,则正反应为放热反应。
,说明温度升高,平衡向逆反应方向移动,则正反应为放热反应。(2)由表中数据可求出到平衡时NO的转化浓度为:(0.020mol-0.007mol)÷2L=0.0065mol?L?1,则NO2增加的浓度为0.0065mol?L?1,符合的曲线为b;v(O2)=1/2(0.020mol-0.008mol)÷2L÷2s=1.5×10-3mol/(L·s)。
(3)a、v(NO2)与v(O2)都表示正反应速率,错误;b、反应前后气体的物质的量不同,容器内压强保持不变,说明反应已达到平衡,正确;c、v逆 (NO)=2v正(O2)表示正反应速率等于逆反应速率,正确;d、根据质量守恒定律,气体的质量不变,容器为2L,密度为定值,不能作为平衡的判断依据,错误。
(4)a、及时分离除NO2气体,反应速率减小,不符合题意;b、因为正反应为放热反应,升温平衡向逆反应方向移动,不符合题意;c、增大O2浓度,反应速率增大,平衡向正反应方向移动,正确;d、高效催化剂同等倍数的增大正、逆反应速率,平衡不移动,不符合题意。

练习册系列答案
相关题目
 Z(g)+W(s) ΔH > 0,
Z(g)+W(s) ΔH > 0, 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
 2SO3(g)。下列说法不正确的是
2SO3(g)。下列说法不正确的是 2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是
2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是


 CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是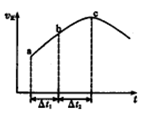
 4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
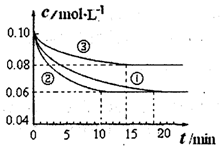
 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。