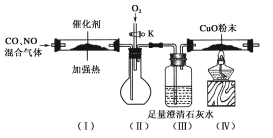
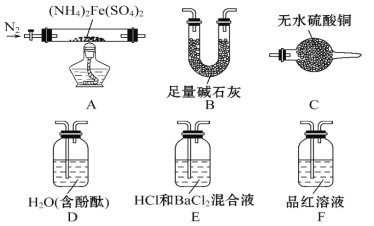
题目内容
【题目】X、Y、Z、W、R、Q 是6 种短周期元素,原子序数依次增大。已知X 组成的单质是最理想的气体燃料,Y 是形成化合物种类最多的元素,X 和Z 形成的化合物M 能使酚酞试液变红,W 的原子最外层电子数是次外层电子数的3 倍, R、Q 位于同一周期, R 是该周期中金属性最强的元素,R 与Q 能形成化合物RQ。
请回答下列问题:
(1)Z 在周期表中的位置是_____;
(2)X、Y 形成最简单有机物的分子空间结构是_____;
(3)W 与R 形成的化合物R2W2 可作供氧剂,该化合物含有的化学键类型有_____, 其供氧反应原理是_____(;用化学方程式表示)
(4)在一定条件下,Q 单质能与硫反应生成一种用途广泛的硫化剂S2Q2;S2Q2 与足量水反应有黄色沉淀生成,同时生成能使品红溶液褪色的无色气体,则该反应的化学方程式是_____;
(5)用电子式表示化合物M 的形成过程_____。
【答案】第二周期第 VA 族 正四面体 离子键和共价键(或非极性共价键) 2Na2O2+2CO2=2Na2CO3+O2 (或 2Na2O2+2H2O=4NaOH+O2 ↑) 2S2Cl2+2H2O=4HCl+SO2↑+3S↓ 3H+![]() →
→![]()
【解析】
X组成的单质是最理想的气体燃料,最理想的气体燃料为H2,燃烧产物为水,不产生污染,也不产生温室效应气体,X为H元素。Y是形成化合物种类最多的元素,有机物的种类最多,有机物中均含有C元素,则Y为C元素。H和Z形成的化合物M可以使酚酞试液变红,则化合物M溶于水之后呈现碱性,M为NH3,Z为N元素。W的原子最外层电子数是次外层电子数的3倍,若次外层是L层, L层可以容纳8个电子,则最外层电子数为24个电子,不符合客观事实。则次外层只能是K层,容纳2个电子,最外层为L层,有6个电子,W为O元素。R和Q位于同一周期,其原子序数比O的大,而且R为金属元素,则R和Q属于第三周期。第三周期金属元素中,金属性最强的为Na,则R为Na元素。R和Q形成化合物RQ,同周期元素形成的化合物中只有NaCl,则Q为Cl元素。
(1) X和Z形成的化合物M可以使酚酞试液变红,则化合物M溶于水之后呈现碱性,M为NH3,Z为N元素。N在元素周期表中的位置为第二周期第 VA 族;
(2) X组成的单质是最理想的气体燃料,最理想的气体燃料为H2,燃烧产物为水,不产生污染,也不产生温室效应气体,X为H元素。Y是形成化合物种类最多的元素,有机物的种类最多,有机物中均含有C元素,则Y为C元素。H和C形成最简单有机物的分子为甲烷,CH4,为正四面体结构;
(3)W是O,R是Na,形成的化合物R2W2,为Na2O2,由Na+和O22-组成,阴阳离子之间存在离子键,O22-中的两个O之间,存在非极性共价键。Na2O2可以供氧是由于其可以与呼出的气体中的CO2和H2O发生反应生成O2,化学方程式为2Na2O2+2CO2=2Na2CO3+O2; 2Na2O2+2H2O=4NaOH+O2↑;
(4)Q的单质为Cl2,与硫反应生成的硫化剂S2Cl2,与足量水反应生成黄色沉淀为S,能使品红溶液褪色的无色气体为SO2。由于Cl的非金属性比S强,Cl和S形成共价键的时候,Cl吸电子能力强,化合价小于0,则在S2Cl2中S的化合价为+1,Cl的化合价为-1。S的化合价降低1价变为O,生成单质S,S的化合价升高3价,生成SO2,为歧化反应,Cl的化合价不变。化合价升降守恒,则S和SO2的物质的量之比为3:1。再根据原子守恒可配平化学方程式答案为2S2Cl2+2H2O=4HCl+SO2↑+3S↓;
(5)M为氨气,3个H原子和N原子通过共价键形成1个氨气分子,表示式为3H+![]() →
→![]() 。
。

【题目】锡是大名鼎鼎的"五金"—金、银、铜、铁、锡之一。四氯化锡可用作媒染剂,可利用如图所 示装置可以制备四氯化锡(部分夹持装置已略去);
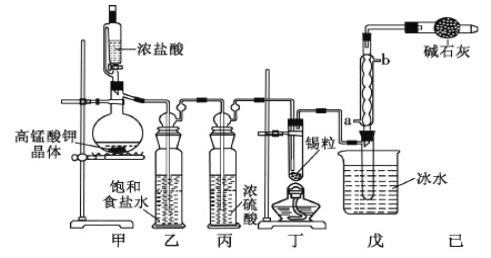
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易被氧化 | 无色液体,易水解 |
回答下列问题:
(1)乙中饱和食盐水的作用为_____;戊装置中冷凝管的进水口为_________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4 被还原为 Mn2+,该反应的离子方程式为_____________________________________
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到丁装置内充满黄绿色气体后,开始加 热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
① 促进氯气与锡反应;
② _____________。
(4)己装置的作用是_____________________。
(5)某同学认为丁装置中的反应可能产生 SnCl2 杂质,以下试剂中可用于检测是否产生 SnCl2 的有________(填标号)。
A.FeCl3 溶液(滴有 KSCN) B.溴水 C.AgNO3 溶液
(6)反应中用去锡粒 1.19g,反应后在戊装置的试管中收集到 2.38g SnCl4,则 SnCl4 的产率为________ 。
【题目】实验室制乙酸乙酯的主要装置如图A所示,主要步骤如下:
①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸汽经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;

③小火加热a试管中的混合液;
④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯。
请回答下列问题:
(1)A装置中使用球形干燥管的作用除了冷凝还有___________,步骤⑤中分离乙酸乙酯的操作名称是_____________。
(2)步骤④中可观察到b试管中的现象为______________,同时有细小气泡产生。
(3)为探究浓硫酸在该反应中起的作用,某化学兴趣小组同学利用上图A所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管b,再测有机层的厚度,实验记录如下:
实验 编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
A | 3 mL乙醇、2 mL乙酸、1mL 18mol·L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1 H2SO4 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、6 mL 6mol·L-1盐酸 | 1.2 |
①由实验B、C、D的记录可得出结论___________________;
②分析实验_________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_________________;
③浓硫酸和加热都有利于提高乙酸乙酯的产率,但实验发现浓硫酸过多或温度过高乙酸乙酯的产率反而降低,可能的原因是____________________;
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为_______(填字母)。
A.NaOH固体 B.无水CaCl2 C.浓硫酸