题目内容
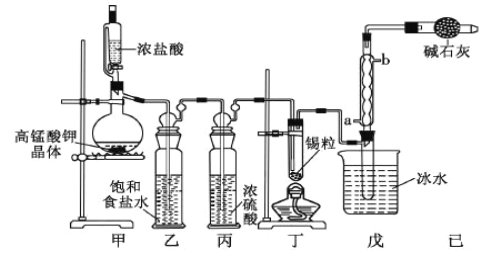
【题目】锡是大名鼎鼎的"五金"—金、银、铜、铁、锡之一。四氯化锡可用作媒染剂,可利用如图所 示装置可以制备四氯化锡(部分夹持装置已略去);
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易被氧化 | 无色液体,易水解 |
回答下列问题:
(1)乙中饱和食盐水的作用为_____;戊装置中冷凝管的进水口为_________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4 被还原为 Mn2+,该反应的离子方程式为_____________________________________
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到丁装置内充满黄绿色气体后,开始加 热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
① 促进氯气与锡反应;
② _____________。
(4)己装置的作用是_____________________。
(5)某同学认为丁装置中的反应可能产生 SnCl2 杂质,以下试剂中可用于检测是否产生 SnCl2 的有________(填标号)。
A.FeCl3 溶液(滴有 KSCN) B.溴水 C.AgNO3 溶液
(6)反应中用去锡粒 1.19g,反应后在戊装置的试管中收集到 2.38g SnCl4,则 SnCl4 的产率为________ 。
【答案】除去氯气中的HCl a 2 MnO4-+10 Cl-+16H+=2 Mn2++5Cl2↑+8H2O 使生成的SnCl4气化,有利于从混合物中分离出来,便于在戊处冷却收集; 吸收未反应的氯气,防止污染环境,同时吸收空气中的水蒸气,防止进入收集SnCl4的试管使其水解 AB 91.2%
【解析】
(1)浓盐酸具有挥发性;采取逆流原理通入冷凝水;
(2)A中发生反应:2KMnO4+16HCl(浓)═2 KCl+2 MnCl2+5Cl2↑+8H2O;
(3)加热丁装置,促进氯气与锡反应,使生成的SnCl4变为气态,便于在戊处冷却收集;
(4)吸收未反应的氯气,防止污染环境,同时吸收空气中的水蒸气,防止进入收集SnCl4的试管使其水解;
(5)由于Sn2+易被Fe3+,可以使用氧化性的FeCl3溶液(滴有KSCN)、溴水,根据颜色变化判断;
(6)根据Sn的质量计算SnCl4的理论产量,产率=实际产量/理论产量×100%。
(1)浓盐酸具有挥发性,乙中饱和食盐水的作用为除去氯气中的HCl;采取逆流原理通入冷凝水,由a口通入冷凝水,冷凝管充满冷凝水,充分进行冷却;
(2)A中发生反应:2KMnO4+16HCl(浓)═2 KCl+2 MnCl2+5Cl2↑+8H2O,离子方程式为:2 MnO4-+10 Cl-+16H+=2 Mn2++5Cl2↑+8H2O;
(3)整个装置中充满氯气时,即丁装置充满黄绿色气体,再加热熔化锡粒合成SnCl4,加热丁装置,促进氯气与锡反应,同时使生成的SnCl4气化,有利于从混合物中分离出来,便于在戊处冷却收集;
(4)己装置作用:吸收未反应的氯气,防止污染环境,同时吸收空气中的水蒸气,防止进入收集SnCl4的试管使其水解,
(5)A.与FeCl3溶液(滴有KSCN)混合,不出现红色,则含有SnCl2,否则无SnCl2,故A正确;
B、与溴水 混合,若橙色褪去,则含有SnCl2,否则无SnCl2,故B正确;
C、使用AgNO3溶液可以检验氯离子,不能检验二价锡,故C错误,
故选AB;
(6)用去锡粒1.19g,其物质的量为1.19g÷119g·mol-1=0.01mol,根据Sn原子守恒理论生成SnCl4为0.01mol,则SnCl4的产率为2.38g÷(0.01mol×261g·mol-1)×100%=91.2%。