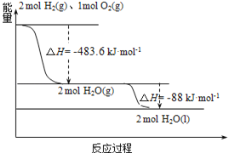
题目内容
【题目】利用如图装置可验证同主族元素非金属性的变化规律
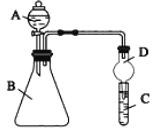
(1)仪器B的名称为________,干燥管D的作用为________。
(2)若要证明非金属性;![]() ,则A中加浓盐酸,B中加
,则A中加浓盐酸,B中加![]() ,(
,(![]() 与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,C溶液中的离子方程式为________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,C溶液中的离子方程式为________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(3)若要证明非金属性:![]() ,则在A中加盐酸,B中加
,则在A中加盐酸,B中加![]() ,C中加________(写化学式)溶液,若观察到C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气瓶。
,C中加________(写化学式)溶液,若观察到C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气瓶。
【答案】锥形瓶 防止倒吸 ![]()
![]()
![]() 饱和
饱和![]()
【解析】
(1)仪器B为锥形瓶,有缓冲作用的装置能防止倒吸;
(2)浓盐酸和高锰酸钾反应生成氯气,氯气能氧化碘离子生成碘,氯气有毒,不能直接排空,可以用碱液吸收氯气;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;盐酸具有挥发性导致生成的二氧化碳中含有HCl,HCl能和硅酸钠反应生成硅酸,要除去HCl,可以用饱和的碳酸氢钠溶液。
(1)仪器B为锥形瓶,有缓冲作用的装置能防止倒吸,则干燥管有缓冲作用,能防止倒吸;
(2)浓盐酸和高锰酸钾反应生成氯气,氯气具有强氧化性、碘离子具有还原性,则氯气能氧化碘离子生成碘,离子方程式为Cl2+2I-=2Cl-+I2,氯气有毒,不能直接排空,但是氯气能和NaOH反应生成无毒的钠盐,所以可以用NaOH溶液吸收多余的氯气;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,要证明非金属性C>Si,稀盐酸和碳酸钙反应生成二氧化碳,二氧化碳和硅酸钠溶液反应生成难溶性的硅酸,由此知碳酸酸性大于硅酸,所以非金属性C>Si,所以C中应该盛放Na2SiO3溶液;盐酸具有挥发性导致生成的二氧化碳中含有HCl,HCl能和硅酸钠反应生成硅酸,所以在将气体通入硅酸钠溶液之前除去HCl,可以用饱和的NaHCO3溶液,则可进入C中干扰实验,应在两装置间添加装有NaHCO3溶液的洗气瓶。

【题目】下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | _____ | _____ | _____ | _____ |
①CH(CH3)3和CH3CH2CH(CH3)2
②C(CH3)4和CH3CH2CH(CH3)2
③CH4和CH3CH2CH3
④金刚石和石墨
⑤H、D、T
⑥12C、13C、14C
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑧臭氧(18O3)和氧气(16O18O )
⑨ 和
和
⑩ H216O和H218O