题目内容
实验室配置FeSO4时,需要向FeSO4溶液中加入
药片
淡绿色溶液
淡红色溶液
血红色溶液
溶液褪色
①的具体操作是
(1)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了血红色,其可能的原因
基于该同学的猜想,请设计实验方案,验证假设2是否正确.写出有关的实验操作、预期现象和结论.(不一定填满,也可以补充)
稀硫酸、铁粉
稀硫酸、铁粉
,目的是加稀硫酸目的是抑制Fe2+水解;加铁粉目的是防止Fe2+被氧气氧化
加稀硫酸目的是抑制Fe2+水解;加铁粉目的是防止Fe2+被氧气氧化
.铁是人体必需的微量元素,缺少时会引起贫血,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”是一种常见的补铁剂,它不溶于水但能溶于人体中的胃酸.某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下所示实验:药片
| ① |
| KSCN溶液 |
| 新制氯水 |
| 一段时间后 |
①的具体操作是
将药片碾碎后溶于稀盐酸,在隔绝空气的情况下静置并过滤.
将药片碾碎后溶于稀盐酸,在隔绝空气的情况下静置并过滤.
.(1)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了血红色,其可能的原因
少量的Fe2+被
少量的Fe2+被
空气中的氧气氧化
空气中的氧气氧化
在实验中发现放置,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,该同学提出了三种假设,请把假设1与假设3补充完整.| 编号 | 猜想 |
| 假设1 | 新制的氯水具有漂白性,溶液被漂白 新制的氯水具有漂白性,溶液被漂白 |
| 假设2 | 溶液中的SCN-被过量的氯水氧化 |
| 假设3 | 溶液中的Fe3+被还原成Fe2+ 溶液中的Fe3+被还原成Fe2+ |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量褪色后溶液,加入KSCN溶液 取少量褪色后溶液,加入KSCN溶液 |
如果溶液变红色,说明该同学的猜想是合理的;如果溶液不变红色,说明乙同学的猜想是不合理的 如果溶液变红色,说明该同学的猜想是合理的;如果溶液不变红色,说明乙同学的猜想是不合理的 |
| ② | 取少量褪色后溶液,加入FeCl3溶液 取少量褪色后溶液,加入FeCl3溶液 |
如果溶液仍不变红色,说明该同学的猜想是合理的;如果溶液变红色,说明该同学的猜想是不合理的 如果溶液仍不变红色,说明该同学的猜想是合理的;如果溶液变红色,说明该同学的猜想是不合理的 |
分析:实验室配制的FeSO4,Fe2+易水解,Fe2+易被氧气氧化.检测“速力菲”药片中Fe2+的存在,在实验中发现放置,溶液的颜色会逐渐褪去,溶液褪色的原因,可能是新制的氯水具有漂白性,溶液被漂白,可能溶液中的SCN-被过量的氯水氧化,可能溶液中的Fe3+被还原成Fe2+.
解答:解:
实验室配制的FeSO4溶液中,由于Fe2+极易被O2氧化而变为黄色的Fe3+溶液;
FeSO4水解,是由于与水电离出的OH-反应,生成氢氧化亚铁,Fe2++2H2O?Fe(OH)2+2H+,由于水的电离是可逆的,当加入稀硫酸,氢离子浓度增大,水的电离平衡向左移动,即抑制水解.
故答案为:稀硫酸、铁粉;加稀硫酸目的是抑制Fe2+水解;加铁粉目的是防止Fe2+被氧气氧化;
①药片
淡绿色溶液,将固体药片先碾碎后溶解,除去不溶物,得淡绿色溶液.
故答案为:将药片碾碎后溶于稀盐酸,在隔绝空气的情况下静置并过滤.
(1)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了血红色,发生反应:Fe3++3SCN-?Fe(SCN)3.
故答案为:少量的Fe2+被空气中的氧气氧化;
在实验中发现放置,溶液的颜色会逐渐褪去,淡红色溶液
血红色溶液,由于氯水具有漂白性,假设1故答案为:新制的氯水具有漂白性,溶液被漂白;Fe3+为黄色,Fe2+为浅绿色,假设3故答案为:溶液中的Fe3+被还原成Fe2+;
假设2溶液中的SCN-被过量的氯水氧化,Fe3++3SCN-?Fe(SCN)3,由于没有SCN-,溶液不变红色,没有Fe3+,溶液不变红色.故验证假设2是否正确.①实验操作的正确答案为:取少量褪色后溶液,加入KSCN溶液;预期现象和结论的正确答案为:如果溶液变红色,说明该同学的猜想是合理的;
②实验操作的正确答案为:取少量褪色后溶液,加入FeCl3溶液;预期现象和结论的正确答案为:如果溶液仍不变红色,说明该同学的猜想是合理的;如果溶液变红色,说明该同学的猜想是不合理的;
故答案为:
.
实验室配制的FeSO4溶液中,由于Fe2+极易被O2氧化而变为黄色的Fe3+溶液;
FeSO4水解,是由于与水电离出的OH-反应,生成氢氧化亚铁,Fe2++2H2O?Fe(OH)2+2H+,由于水的电离是可逆的,当加入稀硫酸,氢离子浓度增大,水的电离平衡向左移动,即抑制水解.
故答案为:稀硫酸、铁粉;加稀硫酸目的是抑制Fe2+水解;加铁粉目的是防止Fe2+被氧气氧化;
①药片
| ① |
故答案为:将药片碾碎后溶于稀盐酸,在隔绝空气的情况下静置并过滤.
(1)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了血红色,发生反应:Fe3++3SCN-?Fe(SCN)3.
故答案为:少量的Fe2+被空气中的氧气氧化;
在实验中发现放置,溶液的颜色会逐渐褪去,淡红色溶液
| 新制氯水 |
假设2溶液中的SCN-被过量的氯水氧化,Fe3++3SCN-?Fe(SCN)3,由于没有SCN-,溶液不变红色,没有Fe3+,溶液不变红色.故验证假设2是否正确.①实验操作的正确答案为:取少量褪色后溶液,加入KSCN溶液;预期现象和结论的正确答案为:如果溶液变红色,说明该同学的猜想是合理的;
②实验操作的正确答案为:取少量褪色后溶液,加入FeCl3溶液;预期现象和结论的正确答案为:如果溶液仍不变红色,说明该同学的猜想是合理的;如果溶液变红色,说明该同学的猜想是不合理的;
故答案为:
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量褪色后溶液,加入KSCN溶液 | 如果溶液变红色,说明该同学的猜想是合理的;如果溶液不变红色,说明乙同学的猜想是不合理的 |
| ② | 取少量褪色后溶液,加入FeCl3溶液 | 如果溶液仍不变红色,说明该同学的猜想是合理的;如果溶液变红色,说明该同学的猜想是不合理的 |
点评:本题综合性强,难度大,解题需正确获取题干信息并能灵活运用所学化学知识,进行分析问题、解决问题.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
实验室配置FeSO4时,需要向FeSO4溶液中加入________,目的是________.铁是人体必需的微量元素,缺少时会引起贫血,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”是一种常见的补铁剂,它不溶于水但能溶于人体中的胃酸.某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下所示实验:
药片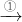 淡绿色溶液
淡绿色溶液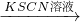 淡红色溶液
淡红色溶液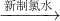 血红色溶液
血红色溶液 溶液褪色
溶液褪色
①的具体操作是________.
(1)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了血红色,其可能的原因________________在实验中发现放置,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,该同学提出了三种假设,请把假设1与假设3补充完整.
| 编号 | 猜想 |
| 假设1 | ________ |
| 假设2 | 溶液中的SCN-被过量的氯水氧化 |
| 假设3 | ________ |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ________ | ________ |
| ② | ________ | ________ |
实验室配置FeSO4时,需要向FeSO4溶液中加入______,目的是______.铁是人体必需的微量元素,缺少时会引起贫血,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”是一种常见的补铁剂,它不溶于水但能溶于人体中的胃酸.某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下所示实验:
药片 淡绿色溶液
淡绿色溶液 淡红色溶液
淡红色溶液 血红色溶液
血红色溶液 溶液褪色
溶液褪色
①的具体操作是______.
(1)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了血红色,其可能的原因____________在实验中发现放置,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,该同学提出了三种假设,请把假设1与假设3补充完整.
基于该同学的猜想,请设计实验方案,验证假设2是否正确.写出有关的实验操作、预期现象和结论.(不一定填满,也可以补充)
药片
 淡绿色溶液
淡绿色溶液 淡红色溶液
淡红色溶液 血红色溶液
血红色溶液 溶液褪色
溶液褪色①的具体操作是______.
(1)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了血红色,其可能的原因____________在实验中发现放置,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,该同学提出了三种假设,请把假设1与假设3补充完整.
| 编号 | 猜想 |
| 假设1 | ______ |
| 假设2 | 溶液中的SCN-被过量的氯水氧化 |
| 假设3 | ______ |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ______ | ______ |
| ② | ______ | ______ |
为了防止FeSO4被氧化而变质,实验室在配置FeSO4溶液时,常在溶液中加入少量的
| A.铜粉 | B.铁粉 | C.锌粉 | D.Fe2(SO4)3 |