题目内容
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-===PbSO4正极PbO2+4H++SO42-+2e-===PbSO4+2H2O
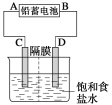
(1)请写出电解饱和食盐水的化学方程式____________。
(2)若在电解池D极滴酚酞试液,电解一段时间后呈红色,说明铅蓄电池的B极为___极。
(3)用铅蓄电池电解2 L饱和食盐水(电解过程假设体积不变)
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
③若消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的物质的量浓度为(假设氯气全部排出)______________(用含a的代数式表示)。
【答案】2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 负 1 22.4 a /2mol·L1
2NaOH+Cl2↑+H2↑ 负 1 22.4 a /2mol·L1
【解析】
本题考查的是电解原理知识。
(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,原子守恒配平写出;
(2)若在电解池D极滴酚酞试液,电解一段时间后呈红色,说明氢离子在D极放电,产生了大量的氢氧根离子,使D极溶液显碱性,则D极为电解池的阴极,阴极与电源负极相连,则B极为电源的负极。
(3)①依据电解氯化钠生成氯气的电极反应计算转移电子物质的量;
②依据铅蓄电池和电解池中电子转移守恒计算;
③依据铅蓄电池电极反应计算消耗硫酸转移电子的物质的量,电解过程中电子守恒,根据电解氯化钠溶液的化学方程式计算电解后溶液中溶质的物质的量浓度。
(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,反应的化学方程式为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。本小题答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑。本小题答案为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(2)若在电解池D极滴酚酞试液,电解一段时间后呈红色,说明氢离子在D极放电,产生了大量的氢氧根离子,使D极溶液显碱性,则D极为电解池的阴极,阴极与电源负极相连,则B极为电源的负极。本小题答案为:负。
(3)①电解氯化钠生成氯气的电极反应为2Cl--2e-=Cl2↑,收集到11.2L(标准状况下)氯气物质的量为0.5mol,转移电子物质的量为1mol。本小题答案为;1。
②蓄电池消耗H2SO42mol,依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗2mol硫酸转移电子2mol,根据电子守恒,电解食盐水阴极电极反应2H++2e-=H2↑,转移电子也为2mol,则生成氢气1mol,标准状况体积为22.4L。本小题答案为:22.4L。
③依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗amol硫酸转移电子amol,根据电子守恒,则2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑反应中转移电子也为amol,则生成氢氧化钠物质的量为amol,氢氧化钠的浓度为amol/2L=
2NaOH+Cl2↑+H2↑反应中转移电子也为amol,则生成氢氧化钠物质的量为amol,氢氧化钠的浓度为amol/2L= ![]() mol/L。本小题答案为:
mol/L。本小题答案为:![]() mol/L。
mol/L。

 名校课堂系列答案
名校课堂系列答案【题目】下图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( )

选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | 石蕊溶液 |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | 石蕊溶液 |
A.AB.BC.CD.D