题目内容
【题目】如图所示,常温下通电5 ![]() 后,发现铜电极的质量增加,试回答:
后,发现铜电极的质量增加,试回答:
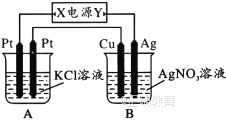
(1)电源电极![]() 的名称为________(填“正极”或“负极”)。
的名称为________(填“正极”或“负极”)。
(2)电解池![]() 中阳极的电极反应式是____________。
中阳极的电极反应式是____________。
(3)若![]() 溶液的体积是200
溶液的体积是200 ![]() ,则当铜电极的质量增加2. 16
,则当铜电极的质量增加2. 16 ![]() 时
时![]() 中溶液的
中溶液的![]() ____________ (忽略电解前后溶液体积的变化),若要使电解后的溶液恢复到与电解前完全相同的状态,则应加入____________(填物质的种类及数量)。
____________ (忽略电解前后溶液体积的变化),若要使电解后的溶液恢复到与电解前完全相同的状态,则应加入____________(填物质的种类及数量)。
(4)已知电解前,电解池B中铜银两电极的质量相等,通电一段时间后,当铜银两电极的质量差为2.16 ![]() 时,电解池A中生成的气体最多为________
时,电解池A中生成的气体最多为________![]() 。
。
【答案】 负极 ![]()
![]()
![]() 13 0.02
13 0.02 ![]()
![]() 0.01
0.01
【解析】(1)通电5 ![]() 后,Cu电极质量增加,是因为Ag+在阴极上放电而析出,即Cu电极是阴极,则Ag电极为阳极,所以电源电极X是负极,电极Y是正极;
后,Cu电极质量增加,是因为Ag+在阴极上放电而析出,即Cu电极是阴极,则Ag电极为阳极,所以电源电极X是负极,电极Y是正极;
(2)Ag电极为电解池B的阳极,电极反应式为Ag-e-=Ag+;
(3)当铜电极的质量增加2. 16g时,即析出n(Ag)=0.02mol,则转移电子n(e-)=0.02mol,根据电子转移守恒可得,在电解池A中,左边阴极析出氢气n(H2)=0.01mol,右边阳极析出氯气n(Cl2)= 0.01mol,而溶液中将增加n(OH-)=0.02mol,所以c(OH-)= 0.02mol/0.2L =0.1mol/L,pH=13,所以要使电解后的溶液恢复到与电解前完全相同的状态,则需要通入0.02mol的HCl气体;
(4)通电前,电解池B的铜、银两电极质量相等,设为mg,设通电过程中转移电子xmol,则Cu电极质量增加,是因为析出了108xg的Ag,而Ag电极质量减小,是因为溶解掉108xg的Ag,当铜银两电极的质量差为2.16g时,即(m+108x)g-(m-108x)g=2.16g,x= n(e-) =0.01mol,则电解池A中产生n(H2)=0.005mol,产生n(Cl2)=0.005mol,所以产生气体最多为0.01mol。