题目内容
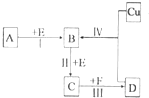 (2011?百色模拟)有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据如图转化关系(反应条件及部分产物已略去),回答下列问题:
(2011?百色模拟)有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据如图转化关系(反应条件及部分产物已略去),回答下列问题:(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,则
①A分子的空间构型为
三角锥形
三角锥形
.②反应I的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
③化合物NaX3是合成“达菲”的中间活性物质,NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式
3NaN3=Na3N+4N2↑
3NaN3=Na3N+4N2↑
.(2)若A、B、C、D均为含Y元素的化合物,且A的摩尔质量为120g?mol-1,则:
①将反应IV所得的溶液加热蒸干得到的晶体属于
离子
离子
晶体(填“离子”、“分子”、“原子”)②反应I的化学方程式为
4FeS2+11O2
2Fe2O3+8SO3
| ||
4FeS2+11O2
2Fe2O3+8SO3
.
| ||
③0.1mol的B(气态)全部转化为C(气态)时放出9.83kJ热量,请写出反应的热化学方程式
2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol
2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol
.分析:两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸,故X、Y两元素一种为N元素,另一种为S元素;
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,故X为N元素,A为NH3,由NH3
B
C,考虑E为O2,B为NO,C为NO2,由Cu+D→B,C
D可知,D为硝酸,F为H2O,验证符合转化关系;
(2)Y元素为S元素,若A、B、C、D均为含Y元素的化合物,由Cu+D→B,考虑D为H2SO4,B为SO2,由B
C
H2SO4,考虑E为O2,C为SO3,F为H2O,由A
B,且A的摩尔质量为120g?mol-1,考虑硫铁矿燃烧,则A为FeS2,验证符合转化关系.
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,故X为N元素,A为NH3,由NH3
| E |
| E |
| F |
(2)Y元素为S元素,若A、B、C、D均为含Y元素的化合物,由Cu+D→B,考虑D为H2SO4,B为SO2,由B
| E |
| F |
| E |
解答:解:两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸,故X、Y两元素一种为N元素,另一种为S元素;
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,故X为N元素,A为NH3,由NH3
B
C,考虑E为O2,B为NO,C为NO2,由Cu+D→B,C
D可知,D为硝酸,F为H2O,验证符合转化关系;
①由上述分析可知,A为NH3,为三角锥形,故答案为:三角锥形;
②反应I是氨气催化氧化生成NO与水,反应方程式为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
③NaN3受撞击后生成Na3N和另一种气体单质,该气体为N2,该反应的化学方程式为:3NaN3=Na3N+4N2↑,故答案为:3NaN3=Na3N+4N2↑;
(2)Y元素为S元素,若A、B、C、D均为含Y元素的化合物,由Cu+D→B,考虑D为H2SO4,B为SO2,由B
C
H2SO4,考虑E为O2,C为SO3,F为H2O,由A
B,且A的摩尔质量为120g?mol-1,考虑硫铁矿燃烧,则A为FeS2,验证符合转化关系.
①将反应IV是铜与硫酸反应生成硫酸铜、二氧化硫与水,所得的溶液是硫酸铜溶液,加热蒸干得到的晶体是硫酸铜晶体,属于离子晶体,故答案为:离子;
②反应I是硫铁矿燃烧生成氧化铁、二氧化硫,反应方程式为:4FeS2+11O2
2Fe2O3+8SO3,故答案为:4FeS2+11O2
2Fe2O3+8SO3;
③0.1mol的SO2(气态)全部转化为SO3(气态)时放出9.83kJ热量,2molSO2完全反应放出的热量为9.83kJ×
=196.6kJ,该反应的热化学方程式为:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol,故答案为:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol.
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,故X为N元素,A为NH3,由NH3
| E |
| E |
| F |
①由上述分析可知,A为NH3,为三角锥形,故答案为:三角锥形;
②反应I是氨气催化氧化生成NO与水,反应方程式为:4NH3+5O2
| ||
| △ |
| ||
| △ |
③NaN3受撞击后生成Na3N和另一种气体单质,该气体为N2,该反应的化学方程式为:3NaN3=Na3N+4N2↑,故答案为:3NaN3=Na3N+4N2↑;
(2)Y元素为S元素,若A、B、C、D均为含Y元素的化合物,由Cu+D→B,考虑D为H2SO4,B为SO2,由B
| E |
| F |
| E |
①将反应IV是铜与硫酸反应生成硫酸铜、二氧化硫与水,所得的溶液是硫酸铜溶液,加热蒸干得到的晶体是硫酸铜晶体,属于离子晶体,故答案为:离子;
②反应I是硫铁矿燃烧生成氧化铁、二氧化硫,反应方程式为:4FeS2+11O2
| ||
| ||
③0.1mol的SO2(气态)全部转化为SO3(气态)时放出9.83kJ热量,2molSO2完全反应放出的热量为9.83kJ×
| 2mol |
| 0.1mol |
点评:本题以无机框图题的形式考查N、S等元素单质及其化合物之间的相互转化关系、逻辑推理能力、化学用语的书写、物质结构等,X、Y两元素最高价氧化物的水化物均为强酸及再周期表中的位置为解题突破口,推断出X、Y元素后,根据题目信息结合转化关系进行推断,对学生的逻辑推理能力提出较高要求.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
 (2011?百色模拟)大豆异黄酮(结构如图)是一种近年来引起营养与医学界广泛关注的物质,它对于人体健康有着重要的作用.关于大豆异黄酮的叙述错误的是( )
(2011?百色模拟)大豆异黄酮(结构如图)是一种近年来引起营养与医学界广泛关注的物质,它对于人体健康有着重要的作用.关于大豆异黄酮的叙述错误的是( )