题目内容
(2011?百色模拟)化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
分析:A、活泼金属采用电解其熔融化合物的方法冶炼.
B、金属的防腐措施中可以采用牺牲阳极的阴极保护法.
C、物质的性质决定其用途.
D、胶体具有吸附性,能其净化作用.
B、金属的防腐措施中可以采用牺牲阳极的阴极保护法.
C、物质的性质决定其用途.
D、胶体具有吸附性,能其净化作用.
解答:解:A、镁是活泼金属,所以镁的冶炼应该采用电解其熔融化合物的方法,电解氯化镁饱和溶液不能得到金属镁,故A错误.
B、在轮船外壳上镶入锌块,锌、铁和海水构成原电池,较活泼的金属锌作负极,铁作正极,负极上失电子发生氧化反应被腐蚀,正极铁被保护,所以可减缓船体的腐蚀速率,故B正确.
C、氧化镁的熔点很高,利用其高熔点可以用于制作耐高温材料,故C正确.
D、明矾是强酸弱碱盐能水解生成氢氧化铝胶体,胶体具有吸附性能吸附水中的悬浮物,所以明矾可用于水的净化,故D正确.
故选A
B、在轮船外壳上镶入锌块,锌、铁和海水构成原电池,较活泼的金属锌作负极,铁作正极,负极上失电子发生氧化反应被腐蚀,正极铁被保护,所以可减缓船体的腐蚀速率,故B正确.
C、氧化镁的熔点很高,利用其高熔点可以用于制作耐高温材料,故C正确.
D、明矾是强酸弱碱盐能水解生成氢氧化铝胶体,胶体具有吸附性能吸附水中的悬浮物,所以明矾可用于水的净化,故D正确.
故选A
点评:本题考查了盐类水解、金属的腐蚀与防护等知识点,易错选项是A,注意活泼金属采用电解其熔融化合物的方法冶炼.

练习册系列答案
相关题目
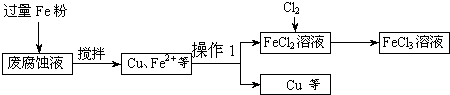
 (2011?百色模拟)大豆异黄酮(结构如图)是一种近年来引起营养与医学界广泛关注的物质,它对于人体健康有着重要的作用.关于大豆异黄酮的叙述错误的是( )
(2011?百色模拟)大豆异黄酮(结构如图)是一种近年来引起营养与医学界广泛关注的物质,它对于人体健康有着重要的作用.关于大豆异黄酮的叙述错误的是( )