题目内容
(2011?百色模拟)用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
分析:A、三价铁离子水解减少;
B、标准状况下,三氧化硫不是气体;
C、溶液体积不知,无法计算;
D、质量换算物质的量,结合化学式减少质子数;
B、标准状况下,三氧化硫不是气体;
C、溶液体积不知,无法计算;
D、质量换算物质的量,结合化学式减少质子数;
解答:解:A、三价铁离子水解,100mL 1mol/L FeC13溶液中含Fe3+数小于0.1NA,故A错误;
B、三氧化硫标准状况下不是气体,22.4L SO3不是1mol,故B错误;
C、溶液体积不知无法计算微粒数目,故C错误;
D、CaCO3与Mg3N2的摩尔质量相同为100g/mol,CaCO3中质子数为20+6+8×3=50;Mg3N2中所含质子数为12×3+7×2=50;所以含质子数相同,所以在0.6g CaCO3与Mg3N2的混合物中所含质子数为0.3NA,故D正确;
故选D.
B、三氧化硫标准状况下不是气体,22.4L SO3不是1mol,故B错误;
C、溶液体积不知无法计算微粒数目,故C错误;
D、CaCO3与Mg3N2的摩尔质量相同为100g/mol,CaCO3中质子数为20+6+8×3=50;Mg3N2中所含质子数为12×3+7×2=50;所以含质子数相同,所以在0.6g CaCO3与Mg3N2的混合物中所含质子数为0.3NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查盐类水解应用,气体摩尔体积的条件应用,质量换算物质的量计算微粒数,关键是CaCO3与Mg3N2的摩尔质量相同,质子数相同.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
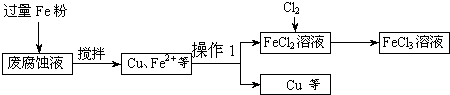
 (2011?百色模拟)大豆异黄酮(结构如图)是一种近年来引起营养与医学界广泛关注的物质,它对于人体健康有着重要的作用.关于大豆异黄酮的叙述错误的是( )
(2011?百色模拟)大豆异黄酮(结构如图)是一种近年来引起营养与医学界广泛关注的物质,它对于人体健康有着重要的作用.关于大豆异黄酮的叙述错误的是( )