题目内容
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右图所示,下列说法中不正确的是
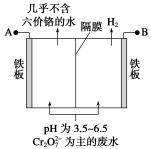
A.A为电源正极
B.阴极区附近溶液pH降低
C.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原
【答案】B
【解析】
试题分析:A、B极上产生氢气,其电极反应式:2H++2e-=H2↑,依据电解的原理,B电极是阴极,A电极是阳极,与电源正极相连,A正确;B、阴极电极反应式:2H2O + 2e- = H2↑ + 2OH-,溶液的pH增大,B错误;C、阳极铁作电极,Fe-2e-=Fe2+,利用Fe2+具有还原性+2价→+3,Cr2O72-具有氧化性+6→+3,最小公倍数是6,依据原子守恒,得出离子反应方程式:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,C正确;D、依据B选项的分析,产生6.72L的氢气,转移电子![]() =1.2mol,同时生成Fe2+物质的量1.2 mol ÷ 2 = 0.6mol,根据C选项的方程式得出有0.1molCr2O72-被还原,D正确,答案选B。
=1.2mol,同时生成Fe2+物质的量1.2 mol ÷ 2 = 0.6mol,根据C选项的方程式得出有0.1molCr2O72-被还原,D正确,答案选B。

练习册系列答案
相关题目