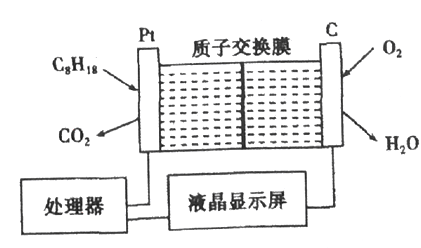
题目内容
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的价电子排布式为_________。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C___Ti(填“>”或“<“,下同);第一电离能:N____O,原因是_________ 。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为___形,其中硫原子的杂化方式为_______,写出与SO42-互为等电子体的一种分子的化学式:________。
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图1,Ti位于立方体的体心。该晶体中,Ca2+的配位数为__。

(5)Fe能形成多种氧化物,其中FeO晶胞结构如图2。FeO晶胞边长为428pm则FeO晶体的密度为____g/cm3(阿伏伽德罗常数的值用NA表示,1pm=10-12m,写出计算式即可)。
【答案】 3d24s2 > > N原子中的2p轨道处于半充满状态,更稳定 正四面体 sp3 CCl4、SiCl4、SO2Cl2等 12 ![]()
【解析】(1)Ti原子核外电子数为22,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d24s2,价电子排布式为3d24s2,故答案为:3d24s2;
(2)同周期自左而右元素电负性增大,故电负性C>B,N原子中的2p轨道处于半充满状态,更稳定,第一电离能高于同周期相邻元素的,故第一电离能N>O,故答案为:>;>;N原子中的2p轨道处于半充满状态,更稳定;
(3)SO42-中S原子孤电子对数=![]() ×(6+22×4)=0,价层电子对数=4+0=4,为正四面体结构,杂化轨道数目为4,S原子杂化方式为sp3;原子数目相同、价电子总数相同的微粒互为等电子体,SO42-的一种等电子体的一种分子为CCl4、SiCl4、SO2Cl2等,故答案为:正四面体;sp3;CCl4、SiCl4、SO2Cl2等;
×(6+22×4)=0,价层电子对数=4+0=4,为正四面体结构,杂化轨道数目为4,S原子杂化方式为sp3;原子数目相同、价电子总数相同的微粒互为等电子体,SO42-的一种等电子体的一种分子为CCl4、SiCl4、SO2Cl2等,故答案为:正四面体;sp3;CCl4、SiCl4、SO2Cl2等;
(4)CaTiO3的晶体结构中Ti位于立方体的体心,由晶胞结构图和化学式可知,顶点为Ca2+,面心为O2-,该晶体中每个顶点Ca2+与面心的O2-相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共用,晶体中,Ca2+和周围紧相邻O2-数目为![]() ×(3×8)=12,即Ca2+的配位数为12,故答案为:12;
×(3×8)=12,即Ca2+的配位数为12,故答案为:12;
(5) FeO晶胞中含有的Fe数目为8×![]() +6×
+6×![]() =4,O原子数目为12×
=4,O原子数目为12×![]() +1=4,1molFeO含有
+1=4,1molFeO含有![]() mol晶胞,则FeO晶体的密度为
mol晶胞,则FeO晶体的密度为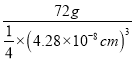 =
=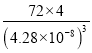 g/cm3,故答案为:
g/cm3,故答案为: 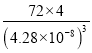 。
。

【题目】在1.013×105Pa下,测得的某些烷烃的沸点见下表。据表分析,下列选项正确的是( )
物质名称 | 沸点/℃ |
正丁烷CH3(CH2)2CH3 | -0.5 |
正戊烷CH3(CH2)3CH3 | 36.1 |
异戊烷 | 27.8 |
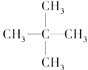
新戊烷 | 9.5 |
正己烷CH3(CH2)4CH3 | 69.0 |
A. 在标准状况时,新戊烷是气体 B. 在1.013×105 Pa、20℃时,C5H12都是液体
C. 烷烃随碳原子数增加,沸点降低 D. C5H12随支链增加,沸点降低