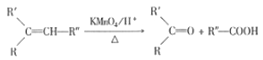题目内容
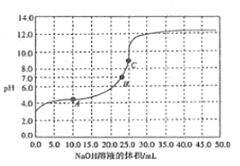
【题目】室温下,用相同浓度的NaOH溶液,分别滴定100mL浓度均为O.1mol/L的三种酸(HM、HN和HR)溶液,滴定的曲线如图所示,下列判断错误的是
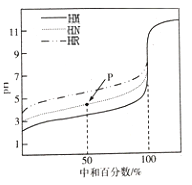
A. 三种酸的电离常数关系:KHM>KHN>KHR
B. pH=7时,三种溶液中:c(M-)>c(N-)>c(R-)
C. 当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR)=c(OH-)-c(H+)
D. 滴定至P点时,溶液中:c(HN)>c(N-)>c(Na+)>c(H+)>c(OH-)
【答案】D
【解析】A.根据图像,0.1mol·L-1的三种酸(HM、HN和HR)溶液的起始pH中HM最小,酸性最强,HR的pH最大,酸性最弱,酸性越强,电离平衡常数越大,三种酸的电离常数关系:KHM>KHN>KHR,A正确;B.pH=7时,三种溶液中阴离子的水解程度不同,加入的氢氧化钠的体积不同,三种离子浓度分别与钠离子浓度相等,但三种溶液中钠离子浓度不等,其中HR需要的氢氧化钠最少,所以三种溶液中:c(M-)>c(N-)>c(R-),B正确;C.此为混合溶液的质子守恒关系式,c(HM)+c(HN)+c(HR)=c(OH-)-c(H+),C正确;D.滴定至P点时溶质为等物质的量浓度的HN和NaN,溶液显酸性,HN的电离为主,但电离程度较小,因此c(N-)>c(Na+)>c(HN)>c(H+)>c(OH-) ,D错误;答案选D。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目