题目内容
17.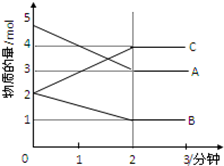 某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体)(1)该反应的化学方程式为2A+B?2C;
(2)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是C(填字母).
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化.
分析 (1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,据此判断.
解答 解:(1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数成正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B?2C,
故答案为:2A+B?2C;
(2)A.气体总质量始终保持不变,所以总质量不变不一定平衡,故错误;
B.A、B、C的浓度不随时间的变化而变化,证明达到了平衡,浓度相等,不一定平衡,故错误;
C.A、B、C的浓度不再发生变化,是平衡的特征,故正确;
D.A、B、C的分子数之比为2:1:2的状态不一定平衡,故错误;
E.达到了平衡时,正反应和逆反应都在进行,但是不是零,故错误;
F.容器内气体密度等于质量和体积的比值,质量始终不变,体积不变,所以密度始终不变,即密度不再发生变化的状态不一定是平衡状态,故错误.
故选C.
点评 本题考查化学实验及化学平衡图象问题,题目难度中等,注意把握由图象判断化学方程式的方法以及平衡状态的判断方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.25℃时,在10mL浓度为0.2mol/L NaOH溶液中,滴加0.1mol/L的醋酸,下列有关溶液中粒子浓度关系正确的是( )
| A. | 未加醋酸时:c(OH-)=c(Na+) | |
| B. | 加入10mL醋酸时:c(OH-)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | 加入醋酸至溶液pH=7时:c(CH3COO-)=c(Na+) | |
| D. | 加入20mL醋酸时:2c(OH-)=c(CH3COO-)+2c(H+) |
5.某种兴奋剂的结构简式如图所示,有关该物质说法正确的是 ( )


| A. | 该分子中所有氢原子不可能在同一平面上 | |
| B. | 1mol该物质与氢气反应,最多消耗4mol氢气 | |
| C. | 加入FeCl3溶液呈紫色,因为该物质含有酚类结构特征 | |
| D. | 滴入酸性高锰酸钾溶液,紫色褪去,可证明结构存在碳碳双键 |
2.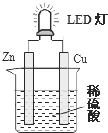 LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
 LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )| A. | 装置中存在“化学能→电能→光能”的转换 | |
| B. | 铜片上发生的反应为:2H++2e-=H2 | |
| C. | 如果将硫酸换成柠檬汁,导线中不会有电子流动 | |
| D. | 如果将锌片换成铁片,电路中的电流方向不变 |
6.因为下列各项的不同,造成反应热△H的大小也不同的是( )
| A. | 反应物和生成物的状态 | B. | 是否使用催化剂 | ||
| C. | 一步完成还是多步完成 | D. | 反应的快慢 |
7.下列关于0.1mol•L-1Ba(NO3)2溶液,说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 该溶液可由1L水中溶解0.1molBa(NO3)2制得 | |
| B. | 1L溶液中含有Ba2+和NO3-离子总数为3NA | |
| C. | 0.5L溶液中Ba2+离子的物质的量浓度为0.2 mol•L-1 | |
| D. | 0.5L溶液中NO3-离子的物质的量浓度为0.2 mol•L-1 |
 乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:
乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是: 请回答实验室分馏石油的有关问题:
请回答实验室分馏石油的有关问题: