题目内容
12.侯德榜是我国著名的化学家,由他发明的侯氏制碱法制得的纯碱中可能含有少量杂质氯化钠,现取仅含氯化钠杂质的纯碱样品22.8g,加入含氯化氢14.6g的稀盐酸中,恰好完全反应,得溶液200g.求:(1)该纯碱样品中Na2CO3的质量;
(2)反应后所得溶液中溶质的质量分数.
分析 (1)纯碱中碳酸钠与稀盐酸反应放出二氧化碳,根据HCl的质量,根据反应的化学方程式,计算出二氧化碳、纯碱中碳酸钠的质量和反应后溶液中溶质氯化钠的质量;
(2)根据“溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%”,计算出反应后所得溶液中溶质的质量分数计算.
解答 解:设参加反应的Na2CO3质量为x,生成的NaCl的质量为y,生成二氧化碳的质量为z.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x 14.6g y z
$\frac{106}{x}=\frac{73}{14.62}=\frac{117}{y}=\frac{44}{z}$
解之得 x=21.2g,y=23.4g,z=8.8g
纯碱样品中NaCl的质量=22.8g-21.2g=1.6g
反应后溶液中NaCl的质量为=23.4g+1.6g=25g
反应后溶液中NaCl的质量分数=$\frac{25g}{200g}$×100%=12.5%
答:(1)该纯碱样品中Na2CO3的质量21.2g;
(2)所得溶液中溶质的质量分数为12.5%.
点评 反应后所得溶液中溶质氯化钠由原粉末中所含的氯化钠与反应后生成的氯化钠两部分所组成,解题时要注意到这点.

练习册系列答案
相关题目
2.某小组利用如图1装置,用苯与溴在FeBr3催化作用下制备溴苯:
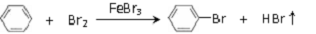
反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按
如图2流程分离产品:
已知:溴苯难溶于水,与有机溶剂互溶;溴、苯、溴苯的沸点依次为59℃、80℃、156℃.
(1)操作Ⅰ为过滤,操作Ⅱ为蒸馏.
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)向“水洗”后所得水相中滴加KSCN溶液,溶液变红色.推测水洗的主要目的是除去FeBr3.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子,并设计实验方案验证你的推测.
(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)


反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按
如图2流程分离产品:
已知:溴苯难溶于水,与有机溶剂互溶;溴、苯、溴苯的沸点依次为59℃、80℃、156℃.
(1)操作Ⅰ为过滤,操作Ⅱ为蒸馏.
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)向“水洗”后所得水相中滴加KSCN溶液,溶液变红色.推测水洗的主要目的是除去FeBr3.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子,并设计实验方案验证你的推测.
(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | |||
| 2 | 锥形瓶中液体含大量Br- | ||
| 3 | 锥形瓶中液体含大量H+ |

3.相同质量的下列各烃,完全燃烧后生成CO2最多的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
20.下列化学方程式中不正确的是( )
| A. | CH3CH2CH2OH+HBr$→_{H+}^{△}$CH3CH2CH2Br+H2O | |
| B. | 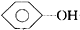 +NaHCO3→ +NaHCO3→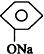 +H2CO3 +H2CO3 | |
| C. | 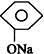 +CO2+H2O→ +CO2+H2O→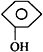 +NaHCO3 +NaHCO3 | |
| D. |  +3Br2→ +3Br2→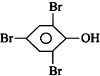 ↓+3HBr ↓+3HBr |
17.下列说法不正确的是( )
| A. | 蔗糖、麦芽糖互为同分异构体 | |
| B. | 常用蛋白质的颜色反应来鉴别部分蛋白质 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物不同 |
1.下列物质中属于纯净物的是( )
| A. | 冰水混合物 | B. | 水泥 | C. | 纯净的盐酸 | D. | 普通玻璃 |
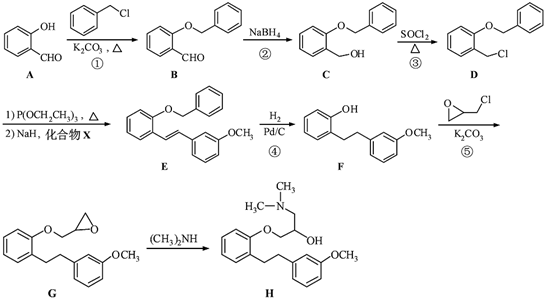
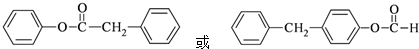 .
.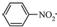 $→_{Pd/C}^{H_{2}}$
$→_{Pd/C}^{H_{2}}$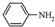 .化合物
.化合物 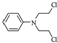 是合成抗癌药物美发伦的中间体,请写出以
是合成抗癌药物美发伦的中间体,请写出以  和
和 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: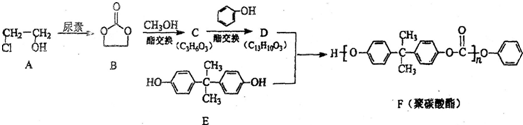
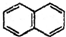 )结构
)结构 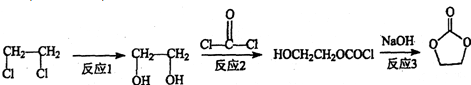

 .
.