题目内容
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ·mol-1
③H2O(l)= H2O(g) △H=+44.0kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方式程为__________。
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
N2(g)+CO2(g)+2H2O(g) △H在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
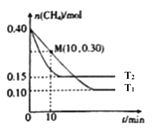
①据图判断该反应的△H_____0(填“﹥”“﹤”“﹦”),理由是:_______________。
②温度为T1时,0~10min内,NO2的平均反应速率v(NO2)=__________。
③该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有______(填字母序号)。
A.改用高效催化剂 B.升高温度 C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液。工作一段时间后,该电池正极附近溶液pH_____(填增大、减小或不变),负极的电极反应式为______________。
【答案】 CO2(g)+ 2NH3(g) = CO(NH2)2(s) + H2O(l) ![]() H=-87.0kJ/mol < T1<T2,T2时CH4的平衡含量高,说明升高温度,化学平衡向逆反应方向移动,逆向吸热,正向放热 0.02mol·L-1·min-1 D 增大 2NH3 - 6e- + 6OH- = N2 + 6H2O
H=-87.0kJ/mol < T1<T2,T2时CH4的平衡含量高,说明升高温度,化学平衡向逆反应方向移动,逆向吸热,正向放热 0.02mol·L-1·min-1 D 增大 2NH3 - 6e- + 6OH- = N2 + 6H2O
【解析】(1)首先写出合成尿素的化学方程式:④CO2+2NH3=CO(NH2)2+H2O,观察发现④=①+②-③,根据盖斯定律可知化学方程式相加减,焓变也跟着相加减,所以生成尿素的焓变△H=-159.5kJ·mol-1+(+116.5kJ·mol-1)-(+44.0kJ·mol-1)=-87.0kJ/mol,所以CO2和NH3合成尿素(副产物是液态水)的热化学方式程为:CO2(g)+ 2NH3(g) = CO(NH2)2(s) + H2O(l) ![]() H=-87.0kJ/mol。
H=-87.0kJ/mol。
(2)①由图可知反应在温度T2时比T1时先达到平衡,所以T1<T2,由T1的平衡态到T2的平衡态,温度升高,甲烷的物质的量增大,说明上述平衡在逆向移动,根据平衡移动的规律可知逆反应方向为吸热反应,所以正反应为放热反应,△H<0,故答案为:△H<0、T1<T2,T2时CH4的平衡含量高,说明升高温度,平衡向逆反应方向移动,逆向吸热,正向放热。②温度为T1时,0~10min内,CH4的物质的量减少0.1mol,所以其浓度减少0.1mol/L, v(CH4 )= 0.1mol/L÷10min=0.01 mol·L-1·min-1,故v(NO2)=2×v(CH4 )= 0.02mol·L-1·min-1。 ③A、催化剂只能加快反应速率,不能改变平衡,NO2的转化率不变,A错误。B、该反应正反应为放热反应,升高温度,反应速率加快,但平衡逆向移动,NO2的转化率降低,B错误。C、缩小容器体积,相当于增大压强,反应速率加快,平衡向气体体积缩小的方向移动,即向逆方向移动,NO2的转化率减小,C错误。D、增加CH4的浓度,反应速率加快,同时平衡正向移动,NO2的转化率增大,D正确,故选择答案D。
(3)正极得到电子发生还原反应,根据总反应可知NO2所在电极为正极,NO2得到电子被还原为N2,同时和水反应生成OH-,电极方程式为NO2+4 e-+2H2O=N2+4OH-,所以正极附近溶液pH增大;负极失去电子发生氧化反应,根据总反应可知NH3所在电极作负极,发生的电极反应为2NH3 - 6e- + 6OH- = N2 + 6H2O。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)═PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率v(PCl3)=0.0032molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11molL﹣1 , 则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2 , 反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2 , 达到平衡时,PCl3的转化率小于80%