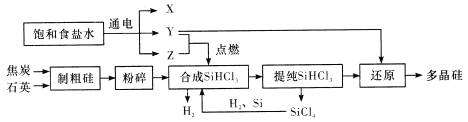
题目内容
【题目】某化工厂生产化工原料的同时会产生多右种废液,其有机废液的主要成分为苯胺、苯酚、苯甲醇(都微溶于水),其无机废液的主要污染成分为Cr2O72-,该工厂处理废液的方法如下:
I.利用物质的酸碱性,从有机废液中分离、回收有机物
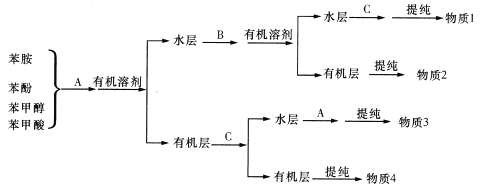
(1)物质A为______,物质B为______, 物质C为_________。(填写化学式)
(2)若想选用一种试剂仅仅将苯甲酸与其他种物质分开,则应选用的试剂是______。
II.利用纳米级Cu2O处理含有Cr2O72-的酸性废水
已知:Cu2O![]() Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
(3)工业上用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________。
(4)光照时,会在形成的微电极上发生电极反应,反应原理如下图所示,

对Cu2O的作用提出两种假设:
a. Cu2O作光催化剂;
b. Cu2O与Cr2O72-发生氧化还原反应
己知:Cu2O的添加量是1.74×10-4mol/L,Cr2O72-的初始浓度是9.60×10-4mol/L;对比实验,反应1.5小时结果如右图所示。结合试剂用量数据和实验结果可得到的结论是假设_____成立,写出该过程的正极反应方程式:_______________。
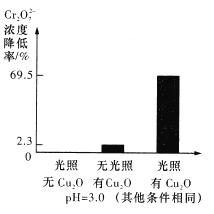
(5)溶液的pH对Cr2O72-降解率的影响如下图所示。

由上图可知,pH=3时,Cr2O72-的降解率最大;pH=2与pH=5时,Cr2O72-的降解率低的原因分别可能是___________、______________。
【答案】 NaOH或Na2CO3 CO2 HCl NaHCO3溶液 N2H4+4Cu(OH)2=2Cu2O+N2↑+6H2O a Cr2O72-+14H++6e-=2Cr3++7H2O pH=2时,Cu2O会转化为Cu和Cu2+ pH=5时,会产生Cr(OH)3沉淀覆盖在催化利Cu2O表面,影响反应继续进行
【解析】苯胺、苯酚、苯甲醇都微溶于水,而苯甲酸与苯酚加入氢氧化钠或碳酸钠溶液,转化为可溶性物质,加入有机溶剂萃取苯胺和苯甲醇,分液得到水层和有机层。水层中含有苯酚钠和苯甲酸钠,苯酚的酸性弱于碳酸,苯甲酸的酸性强于碳酸,因此通入CO2即可把苯酚钠转化为苯酚,物质2是苯酚。盐酸是强酸,向苯甲酸钠溶液中加入盐酸生成苯甲酸,即物质1是苯甲酸;苯胺含有氨基,能与盐酸反应转化为可溶性物质,分液得到水层,加入氢氧化钠再转化为苯胺,物质3是苯胺,物质4是苯甲醇。
(1)根据以上分析可知物质A为NaOH或Na2CO3,物质B为CO2,物质C为HCl。(2)若想选用一种试剂仅仅将苯甲酸与其他种物质分开,由于其余物质与碳酸氢钠均不反应,则应选用的试剂是NaHCO3溶液。(3)工业上用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,根据原子守恒和电子得失守恒可知该反应的化学方程式为N2H4+4Cu(OH)2=2Cu2O+N2↑+6H2O。(4)若发生氧化还原反应,则存在比例:3Cu2O~Cr2O72-,计算9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol/L;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在,因此假设a成立,正极发生得到电子的还原反应,则正极反应式为Cr2O72-+14H++6e-=2Cr3++7H2O;(5)由图可知:pH=2.5时Cu2O会歧化(转化)为Cu 和Cu2+;根据已知信息可知pH=5时,会产生Cr(OH)3沉淀覆盖在催化剂Cu2O表面,影响反应继续进行。

【题目】一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
(1)用NO2表示0~2 s内该反应的平均速度___________.在第5 s时,NO2的转化率为_____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是_____________________。
(2)上述反应在第3 s后达到平衡,能说明该反应已达到平衡状态的是______。
a.单位时间内,消耗2 mol NO2的同时生成1 mol的N2O4
b.容器内压强保持不变
c.v逆(NO2)=2v正(N2O4)
d.容器内密度保持不变
(3)在2 s内,该反应_______(“吸收”或“放出”) _______热量。