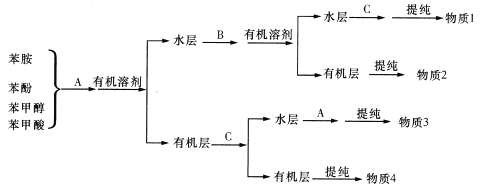
题目内容
【题目】下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )
A. 氯气
B. 氯水
C. 氯化钾
D. 氯化铵
【答案】D
【解析】
A. 氯气与水反应生成盐酸和HClO,可破坏水的电离,但氯气是单质,既不是电解质也不是非电解质,故A不选;
B. 氯水是混合物,含有盐酸和次氯酸,可破坏水的电离,既不是电解质也不是非电解质,故B不选;
C. 氯化钾溶于水电离出氯离子和钾离子,氯化钾是强电解质,向溶液中加入氯化钾,不破坏水的电离,故C不选;
D. 氯化铵属于强酸弱碱盐,铵根水解,破坏了水的电离平衡,氯化铵属于盐,是强电解质,故D选;答案:D。

练习册系列答案
相关题目