题目内容
【题目】(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是______________,只有还原性的是____________,既有氧化性又有还原性的是______________。
(2)分析氧化还原反应2P+5Br2+8H2O=2H3PO4+10HBr,用“双线桥法”表示出反应中电子转移的方向和数目为_______________________。
反应中氧化剂与还原剂的物质的量之比为____________________。
(3) 氧化还原反应3S + 6KOH = K2S + K2SO3 + 3H2O中,氧化产物是______________,还原产物是_______________。该反应的离子方程式为:___________________。
【答案】
(1)Fe3+、Mg2+、H+;S2-、I-;Fe2+、S
(2)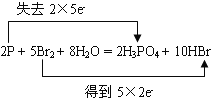 ;5:2。
;5:2。
(3)K2SO3,K2S;3S+6OH-=2S2-+SO32-+3H2O。
【解析】
试题分析:(1)Fe3+、Mg2+、H+中的化合价都是最高价态,所以都只有氧化性;S2-、I-中的化合价都是最低价态,所以都只有还原性;Fe2+、S中的化合价是中间价态,所以既有氧化性又有还原性,故答案为:H+、Mg2+、Fe3+;S2-、I-;Fe2+、S
(2)电子转移的方向和数目为 ;反应中P元素的化合价升高,P为还原剂,Br元素的化合价降低,为氧化剂Br2,氧化剂与还原剂的物质的量之比为,故答案为:
;反应中P元素的化合价升高,P为还原剂,Br元素的化合价降低,为氧化剂Br2,氧化剂与还原剂的物质的量之比为,故答案为: ;5:2;
;5:2;
(3)3S+6KOH=K2S+K2SO3+3H2O反应中,S元素的化合价部分升高到+4价,被氧化为K2SO3,因此氧化产物为K2SO3,部分降低到-2价,生成K2S,还原产物为K2S。该反应的离子方程式为,故答案为:K2SO3,K2S;3S+6OH-=2S2-+SO32-+3H2O。

【题目】
用已知浓度的HCl溶液测定未知浓度的氨水,选用的指示剂_____________
(2)取体积相同的、物质的量浓度相同的两分NaOH溶液,把其中的一份放空气中一段时间后。用已知浓度的硫酸中和上述这两份溶液,若中和第一份(放在空气中一段时间)所消耗硫酸溶液体积为V1,另一份消耗硫酸溶液体积为V2,
①若以甲基橙为指示剂时,V1和V2的关系是_ ___
②若以酚酞为指示剂时,V1和V2的关系是__ ____
(3)用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用 0.20mol·L-1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
①根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
②达到滴定终点的标志是_______________
③以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
