题目内容
【题目】能量是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知:C(s)+O2(g)=CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)=H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)=CO(g)+H2(g)的焓变ΔH=________kJ·mol-1。
(2)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作电解质。向负极充入燃料气CH4,用空气与 CO2 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中, CO32-移向_________极(填“正”或“负”) ,已知 CH4 发生的电极反应式为 CH4 + 4CO32-―8e-= 5CO2+2H2O,则另一极的电极反应方程式为:
(3)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D 均为铂电极,
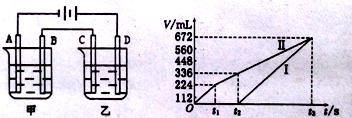
A.甲槽中有200ml一定浓度的NaCl与C uSO4混合溶液,理论上两极所得气体的体积随时间变化的关系入上图所示(气体体积已换算成标准状况下的体积),(电解前后溶液的体积变化关系忽略不计)
①原混合溶液NaCl的物质的量浓度 mol/L, CuSO4的物质的量浓度 mol/L。
②t2时所得溶液的pH=___________
B.乙槽CuSO4 溶液200ml。乙槽内电解的总化学方程式________________;
①当 C 极析出 0.64g 物质时,乙杯溶液中生成的硫酸为_________mol。电解后,若使乙池内的溶液完全复原,可向乙池中加入_____________(选填字母标号)
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
②若通电一段时间后,向所得的乙杯溶液中加入 0.2mol 的 Cu(OH)2 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为______________。
【答案】
(1)+131.5;
(2)负;O2+CO2+4e-=CO32-
(3)A、①0.1;0.1 ②1;
B、2Cu2++2H2O=2Cu+O2+4H+;①0.01;BC ②0.8NA
【解析】
试题分析:(1)①C(s)+O2(g)═CO2(g)△H=-437.3kJmol-1,②H2(g)+![]() O2(g)═H2O(g)△H=-285.8kJmol-1,③CO(g)+
O2(g)═H2O(g)△H=-285.8kJmol-1,③CO(g)+![]() O2(g)═CO2(g)△H=-283.0kJmol-1,依据盖斯定律计算,①-②-③得到固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是:C(s)+H2O(g)=CO2(g)+H2(g)△H=-131.5kJmol-1;故答案为:-131.5kJmol-1;
O2(g)═CO2(g)△H=-283.0kJmol-1,依据盖斯定律计算,①-②-③得到固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是:C(s)+H2O(g)=CO2(g)+H2(g)△H=-131.5kJmol-1;故答案为:-131.5kJmol-1;
(2)甲烷燃料电池中,负极上甲烷被氧化,电极方程式为CH4+4CO32--8e-=5CO2+2H2O,正极发生的反应是氧气得电子的过程,电极反应为:O2+2CO2+4e-=2CO32-,生成的CO32-向负极移动,故答案为:负;O2+CO2+4e-=CO32-;
(3)A、电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系。
①由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=![]() ×2=0.02mol,所以c(NaCl)=
×2=0.02mol,所以c(NaCl)=![]() =0.1mol/L,由t2时生成氧气为112mL,n(O2)=
=0.1mol/L,由t2时生成氧气为112mL,n(O2)=![]() =0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=
=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=![]() =0.02mol,所以c(CuSO4)=
=0.02mol,所以c(CuSO4)=![]() =0.1mol/L,故答案为:0.1;0.1;
=0.1mol/L,故答案为:0.1;0.1;
②由t2时4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=![]() =0.1mol/L,因此pH=-lg c(H+)=-lg0.1=1,故答案为:1;
=0.1mol/L,因此pH=-lg c(H+)=-lg0.1=1,故答案为:1;
B、乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;
2Cu+O2↑+2H2SO4;
①取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为![]() =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,阳极反应的氢氧根离子的物质的量为0.2mol,生成的硫酸为0.1mol,根据电极方程式,电解过程中损失的元素有铜和氧,A、多加了H元素,错误;B、能够补充铜和氧元素,正确;C、CuCO3与硫酸反应放出二氧化碳,相当于加入了氧化铜,正确;D.Cu2(OH)2CO3多加了H元素,错误;故选BC;
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,阳极反应的氢氧根离子的物质的量为0.2mol,生成的硫酸为0.1mol,根据电极方程式,电解过程中损失的元素有铜和氧,A、多加了H元素,错误;B、能够补充铜和氧元素,正确;C、CuCO3与硫酸反应放出二氧化碳,相当于加入了氧化铜,正确;D.Cu2(OH)2CO3多加了H元素,错误;故选BC;
②加入0.2 mol Cu(OH)2后恰好恢复到电解前的浓度,Cu(OH)2从组成上可看成CuOH2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成0.2mol铜转移电子个数=0.2mol×2 =0.4mol,根据原子守恒知,生成0.2mol水需要0.2mol氢气,生成0.2mol氢气转移电子的个数=0.2mol×2 =0.4mol,所以电解过程中共转移电子数为0.8mol,数目为0.8NA,故答案为:0.8NA。