题目内容
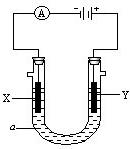 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解 液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解 液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是
②Y电极上的电极反应式是
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是
②Y电极的材料是
③假若电路中有0.04摩尔电子通过时,阴极增重
分析:(1)电解饱和氯化钠溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子离子失电子,阴极上是氢离子得电子;
(2)根据电解精炼铜的工作原理知识来回答.
(2)根据电解精炼铜的工作原理知识来回答.
解答:解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,X电极负极水的电离被破坏,氢氧根离子浓度增大,溶液呈红色,
故答案为:2H++2e-=H2↑;溶液呈红色;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,检验氯气的方法是用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色,
故答案为:2Cl--2e-=Cl2↑;用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色;
(2)①电解方法精炼粗铜,X为阴极,电解池的阴极材料是纯铜,电极反应为Cu2++2e-=Cu,故答案为:纯铜;Cu2++2e-=Cu;
②电解方法精炼粗铜,Y为阳极,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+;
③阴极反应为Cu2++2e-=Cu,当电路中有0.04mol电子通过时,应生成Cu 0.02mol,质量为1.28g,故答案为:1.28.
故答案为:2H++2e-=H2↑;溶液呈红色;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,检验氯气的方法是用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色,
故答案为:2Cl--2e-=Cl2↑;用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色;
(2)①电解方法精炼粗铜,X为阴极,电解池的阴极材料是纯铜,电极反应为Cu2++2e-=Cu,故答案为:纯铜;Cu2++2e-=Cu;
②电解方法精炼粗铜,Y为阳极,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+;
③阴极反应为Cu2++2e-=Cu,当电路中有0.04mol电子通过时,应生成Cu 0.02mol,质量为1.28g,故答案为:1.28.
点评:本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.

练习册系列答案
相关题目
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: (I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
(I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2. 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.