题目内容
【题目】化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。I可以用E和H在一定条件下合成:
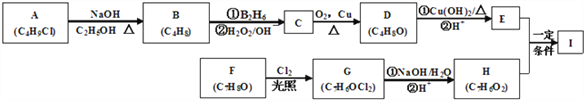
已知以下信息:
A的核磁共振氢谱表明其只有一种化学环境的氢;R—CH=CH2![]() R—CH2CH2OH
R—CH2CH2OH
化合物F苯环上的一氯代物只有两种;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)C的化学名称为________________________。
(2)E的结构简式为______________________。
(3)A→B的反应类型为_________________、__________________;E+H→I的反应类型为_______________________。
(4)F生成G的化学方程式为____________________________________。
(5)E+H→I的化学方程式为___________________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基;②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,这样的同分异构体共有_______种(不考虑立体异构)。J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式___________。
【答案】2-甲基-1-丙醇 (CH3)2CHCOOH 消去反应 中和反应 酯化反应(或取代反应) 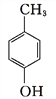 +2Cl2
+2Cl2![]()
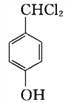 +2HCl (CH3)2CHCOOH +
+2HCl (CH3)2CHCOOH + 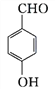
![]()
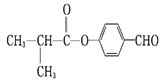 + H2O 18
+ H2O 18 ![]()
【解析】
A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为C(CH3)3Cl;C(CH3)3Cl在氢氧化钠的乙醇溶液中加热发生消去反应生成烯B为(CH3)2CH=CH2;根据R—CH=CH2![]() R—CH2CH2OH可知,(CH3)2CH=CH2反应生成C为(CH3)2CH2CH2OH;(CH3)2CH2CH2OH在铜的催化下氧化生成D为(CH3)2CH2CHO;(CH3)2CH2CHO在新制的氢氧化铜县浊液中加热氧化后酸化得到E为(CH3)2CHCOOH;化合物F分子式为C7H8O,苯环上的一氯代物只有两种,则F为对甲基苯酚
R—CH2CH2OH可知,(CH3)2CH=CH2反应生成C为(CH3)2CH2CH2OH;(CH3)2CH2CH2OH在铜的催化下氧化生成D为(CH3)2CH2CHO;(CH3)2CH2CHO在新制的氢氧化铜县浊液中加热氧化后酸化得到E为(CH3)2CHCOOH;化合物F分子式为C7H8O,苯环上的一氯代物只有两种,则F为对甲基苯酚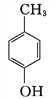 ;
; 在光照条件下与氯气发生取代反应生成二氯代物G为
在光照条件下与氯气发生取代反应生成二氯代物G为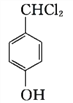 ,
, 在氢氧化钠的水溶液中加热发生水解,通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。则生成的H为
在氢氧化钠的水溶液中加热发生水解,通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。则生成的H为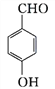 ;
; 与(CH3)2CHCOOH在一定条件下反应生成I为
与(CH3)2CHCOOH在一定条件下反应生成I为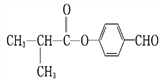 。(1)C为(CH3)2CH2CH2OH,化学名称为2-甲基-1-丙醇;(2)E的结构简式为(CH3)2CHCOOH;(3)A→B是C(CH3)3Cl在氢氧化钠的乙醇溶液中加热发生消去反应生成 (CH3)2CH=CH2;,反应类型为消去反应、中和反应;E+H→I是
。(1)C为(CH3)2CH2CH2OH,化学名称为2-甲基-1-丙醇;(2)E的结构简式为(CH3)2CHCOOH;(3)A→B是C(CH3)3Cl在氢氧化钠的乙醇溶液中加热发生消去反应生成 (CH3)2CH=CH2;,反应类型为消去反应、中和反应;E+H→I是 与(CH3)2CHCOOH在一定条件下反应生成
与(CH3)2CHCOOH在一定条件下反应生成 和水,反应类型为酯化反应或取代反应;(4)F生成G是
和水,反应类型为酯化反应或取代反应;(4)F生成G是 在光照条件下与氯气发生取代反应生成
在光照条件下与氯气发生取代反应生成 和氯化氢,化学方程式为
和氯化氢,化学方程式为 +2Cl2
+2Cl2![]()
 +2HCl ;(5)E+H→I是
+2HCl ;(5)E+H→I是 与(CH3)2CHCOOH在一定条件下反应生成
与(CH3)2CHCOOH在一定条件下反应生成 和水,化学方程式为(CH3)2CHCOOH +
和水,化学方程式为(CH3)2CHCOOH + 
![]()
 + H2O;(6)I(
+ H2O;(6)I( )的同系物J比I相对分子质量小14,则少一个CH2,J的同分异构体中能同时满足如下条件:
)的同系物J比I相对分子质量小14,则少一个CH2,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基;②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则含有一个醛基和一个羧基,则除苯环外两个取代基可以是-CHO和-CH2CH2COOH、-CHO和-CH(CH3)COOH、-CH2CHO和-CH2COOH、-CH(CH3)CHO和-COOH、-CH2CH2CHO和-COOH、-CH3和-CH(CHO)COOH六种,而在苯环上两个取代基的位置有邻、间、对位,故共有18种同分异构体; J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,则酸化后高度对称两个羧基等效,J的这种同分异构体的结构简式为![]() 。
。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化。
(1) 已知:2NO(g)+O2(g)===2NO2(g) ΔH1
NO(g)+O3(g)===NO2(g)+O2(g) ΔH2
2NO2(g)![]() N2O4(g) ΔH3
N2O4(g) ΔH3
2N2O5(g)===4NO2(g)+O2(g) ΔH4
则反应N2O4(g)+O3(g)===N2O5(g)+O2(g)的ΔH=__________。
(2)从N2O5在一定条件下发生分解:2N2O5(g)===4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/ (mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
(3)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。

①图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②由图推测N2O4(g)![]() 2NO2(g)是吸热反应还是放热反应,说明理由_______________,若要提高N2O4转化率,除改变反应温度外,其他措施有____________(要求写出两条)。
2NO2(g)是吸热反应还是放热反应,说明理由_______________,若要提高N2O4转化率,除改变反应温度外,其他措施有____________(要求写出两条)。
【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________,第二周期第一电离能比B高的元素有_______种。
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________ (标出配位键),其中心原子的 VSEPR模型名称为________,写出[BH4]-的两种等电子体_____________________。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________。
图1 | 图2 | 图3 |
|
|
|
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________;同一片层划分出的一个二维晶胞(平行四边形)含有_______个H3BO3分子。
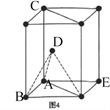
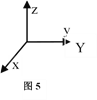
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:__________________