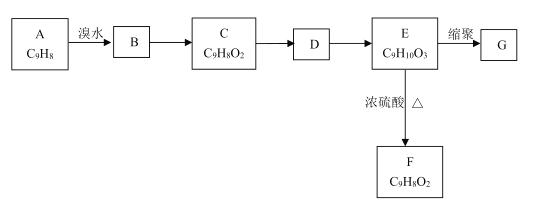
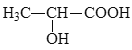题目内容
【题目】回答下列问题。
(1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。

①判断下列化合物中属于离子化合物的是________(填字母);
A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC
②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为__________________________;NCl3水解产物为____________________。
(2)观察Li、Be、Mg、Al在元素周期表中的位置回答:
![]()
①铍的最高价氧化物的水化物是________(填“酸性”、“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是_____________________________________________________;
②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为__________(用化学式表示)。
(3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)
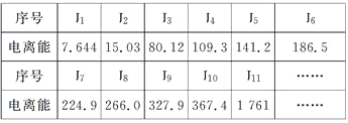
①外层电子离核越远,能量越高,电离能越__________(填“大”或“小”);阳离子电荷数越高,失去电子时,电离能越________(填“大”或“小”);
②上述11个电子分属________个电子层;
③失去了11个电子后,该元素还有________个电子;
④该元素最高价氧化物对应水化物的化学式是______________________________________。
【答案】A PCl3+3H2O=H3PO3+3HCl HClO、NH3·H2O 两性 Be(OH)2+2OH-=BeO22-+2H2O、Be(OH)2+2H+=Be2++2H2O Li2O、Li3N 小 大 3 1 Mg(OH)2
【解析】
(1)①根据形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键分析;
②PCl3、NCl3均能发生水解反应,结合元素化合价分析水解产物;
(2)①铍的最高价氧化物的水化物是两性化合物;两性化合物与强酸、强碱均反应生成盐和水;
②Mg和Li相似,Mg在空气中燃烧生成MgO和Mg3N2;
(3)同一种元素的原子,其电离能随着失电子个数的增多而增大,当原子失去电子变为稳定状态时,如果继续失电子,则其电离能会出现突兀性变化,据此判断该元素最外层电子数,据此解答。
(1)①A.Mg3N2电负性差值为3.0-1.2=1.8,大于1.7形成离子键,属于离子化合物;
B.BeCl2电负性差值为3.0-1.5=1.5,小于于1.7形成共价键,属于共价化合物;
C.AlCl3电负性差值为3.0-1.5=1.5,小于于1.7形成共价键,属于共价化合物;
D.SiC电负性差值为2.5-1.8=0.7,小于于1.7形成共价键,属于共价化合物;
故答案为A;
②水解反应前后各元素的化合价不变,Cl的电负性大于P,所以在PCl3中P为+3价,Cl为-1价,则在PCl3水解的产物中P元素的化合价是+3价,Cl元素的化合价是-1价,PCl3水解反应的化学方程式为PCl3+3H2O=H3PO3+3HCl;水解反应前后各元素的化合价不变,由题意知NCl3中N的化合价为-3价,Cl的化合价为+1价,则在NCl3水解的产物中N的化合价是-3价,Cl的化合价是+1价,其水解产物是HClO和NH3·H2O;
(2)①铍和铝的性质相似,铝的最高价氧化物的水化物是两性化合物,则铍的最高价氧化物的水化物是两性化合物;两性化合物与强酸、强碱均反应生成盐和水,离子反应分别为Be(OH)2+2H+═Be2++2H2O、Be(OH)2+2OH-═BeO22-+2H2O;
②Mg和Li相似,Mg在空气中燃烧生成MgO和Mg3N2,所以Li在空气中燃烧生成的产物为Li2O和Li3N;
(3)①外层电子离核越远,能量越高,失去外层电子越容易,电离能越小;阳离子电荷数越高,再失去电子就越因难,电离能越大;
②根据核外电子排布可知11个电子应排为:1s22s22p63s1,则这11个电子分属3个电子层;
③根据失去第一个、第二个电子的能量比失去第三个电子的能量小很多,得知该元素易失去2个电子,又因该元素可以失去的电子能达到11个,故在前20号中只有镁符合要求,镁是12号元素,失去11个电子后,还有1个电子;
④镁的最高价为+2价,其氧化物MgO对应水化物的化学式是Mg(OH)2。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案